Equipo 1
Calor
El calor se define como la transferencia de energía térmica que se da entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintas temperaturas, sin embargo en termodinámica generalmente el término calor significa transferencia de energía. Este flujo de energía siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura, ocurriendo la transferencia hasta que ambos cuerpos se encuentren en equilibrio térmico (ejemplo: una bebida fría dejada en una habitación se entibia).
La energía calórica o térmica puede ser transferida por diferentes mecanismos de transferencia, estos son la radiación, la conducción y la convección, aunque en la mayoría de los procesos reales todos se encuentran presentes en mayor o menor grado. Cabe resaltar que los cuerpos no tienen calor, sino energía térmica. La energía existe en varias formas. En este caso nos enfocamos en el calor, que es el proceso mediante el cual la energía se puede transferir de un sistema a otro como resultado de la diferencia de temperatura.


Historia del concepto[editar]
Hasta el siglo XIX se explicaba el efecto del ambiente en la variación de la temperatura de un cuerpo por medio de un fluido invisible llamadocalórico. Este se producía cuando algo se quemaba y, además, que podía pasar de un cuerpo a otro. La teoría del calórico afirmaba que una sustancia con mayor temperatura que otra, necesariamente, poseía mayor cantidad de calórico.
Benjamin Thompson y James Prescott Joule establecieron que el trabajo podía convertirse en calor o en un incremento de la energía térmica determinando que, simplemente, era otra forma de la energía.
Calor específico[editar]
El calor específico es la energía necesaria para elevar 1 °C la temperatura de un gramo de materia. El concepto de capacidad calorífica es análogo al anterior pero para una masa de un mol de sustancia (en este caso es necesario conocer la estructura química de la misma).
El calor específico es un parámetro que depende del material y relaciona el calor que se proporciona a una masa determinada de una sustancia con el incremento de temperatura:
donde:
 es el calor aportado al sistema.
es el calor aportado al sistema. es la masa del sistema.
es la masa del sistema. es el calor específico del sistema.
es el calor específico del sistema.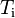 y
y 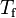 son las temperaturas inicial y final del sistema respectivamente.
son las temperaturas inicial y final del sistema respectivamente. es el diferencial de temperatura.
es el diferencial de temperatura.
Las unidades más habituales de calor específico son J / (kg · K) y cal / (g · °C).
El calor específico de un material depende de su temperatura; no obstante, en muchos procesos termodinámicos su variación es tan pequeña que puede considerarse que el calor específico es constante. Asimismo, también se diferencia del proceso que se lleve a cabo, distinguiéndose especialmente el "calor específico a presión constante" (en unproceso isobárico) y "calor específico a volumen constante (en un proceso isocórico).
De esta forma, y recordando la definición de caloría, se tiene que el calor específico del agua es aproximadamente:
Calor específico molar[editar]
El calor específico de una sustancia está relacionado su constitución molecular interna, y a menudo da información valiosa de los detalles de su ordenación molecular y de las fuerzas intermoleculares. A altas temperaturas la mayoría de sólidos tienen capacidades caloríficas molares del orden de  (ver Ley de Dulong-Petit, siendo
(ver Ley de Dulong-Petit, siendo 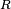 laconstante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a
laconstante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a  y difiere de la de gases diatómicos
y difiere de la de gases diatómicos  . En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
. En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
 (ver Ley de Dulong-Petit, siendo
(ver Ley de Dulong-Petit, siendo 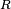 laconstante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a
laconstante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a  y difiere de la de gases diatómicos
y difiere de la de gases diatómicos  . En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
. En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
donde n indica la cantidad de moles en la sustancia presente. Esta capacidad usualmente es función de la temperatura  .
.
 .
.Capacidad calorífica[editar]
La capacidad calorífica de una sustancia es una magnitud que indica la mayor o menor dificultad que presenta dicha sustancia para experimentar cambios de temperatura bajo el suministro de calor. Se denota por 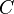 , se acostumbra a medir en J/K, y se define como:
, se acostumbra a medir en J/K, y se define como:
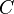 , se acostumbra a medir en J/K, y se define como:
, se acostumbra a medir en J/K, y se define como:
Dado que:
De igual forma se puede definir la capacidad calórica molar como:
Cambios de fase[editar]
En la naturaleza existen tres estados usuales de la materia: sólido, líquido y gaseoso. Al aplicarle calor a una sustancia, ésta puede cambiar de un estado a otro. A estos procesos se les conoce como cambios de fase. Los posibles cambios de fase son:
- de estado sólido a líquido, llamado fusión,
- de estado líquido a sólido, llamado solidificación,
- de estado líquido a gaseoso, llamado evaporación o vaporización,
- de estado gaseoso a líquido, llamado condensación,
- de estado sólido a gaseoso, llamado sublimación progresiva,
- de estado gaseoso a sólido, llamado sublimación regresiva o deposición,
- de estado gaseoso a plasma, llamado ionización.
- de estado plasma a gaseoso, llamado Desionización
Calor latente[editar]
Un cuerpo sólido puede estar en equilibrio térmico con un líquido o un gas a cualquier temperatura, o que un líquido y un gas pueden estar en equilibrio térmico entre sí, en una amplia gama de temperaturas, ya que se trata de sustancias diferentes. Pero lo que es menos evidente es que dos fases o estados de agregación, distintas de una misma sustancia, puedan estar en equilibrio térmico entre sí en circunstancias apropiadas.
Un sistema que consiste en formas sólida y líquida de determinada sustancia, a una presión constante dada, puede estar en equilibrio térmico, pero únicamente a una temperatura llamada punto de fusión simbolizado a veces como 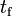 . A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latente de fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por
. A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latente de fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por  .
.
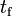 . A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latente de fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por
. A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latente de fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por  .
.
El calor de fusión representa la energía necesaria para deshacer la fase sólida que está estrechamente unida y convertirla en líquido. Para convertir líquido en sólido se necesita la misma cantidad de energía, por ello el calor de fusión representa la energía necesaria para cambiar del estado sólido a líquido, y también para pasar del estado líquido a sólido.
El calor de fusión se mide en cal / g.
De manera similar, un líquido y un vapor de una misma sustancia pueden estar en equilibrio térmico a una temperatura llamada punto de ebullición simbolizado por  . El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición oentalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por
. El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición oentalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por 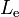 .
.
 . El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición oentalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por
. El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición oentalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por 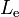 .
.
En la siguiente tabla se muestran algunos valores de los puntos de fusión y ebullición, y entalpías de algunas sustancias:
| sustancias | 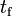 [°C] [°C] |  [cal/g] [cal/g] |  [°C] [°C] | 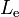 [cal/g] [cal/g] |
| H2O | 0,00 | 79,71 | 100,00 | 539,60 |
| O2 | -219,00 | 3,30 | -182,90 | 50,90 |
| Hg | -39,00 | 2,82 | 357,00 | 65,00 |
| Cu | 1083,00 | 42,00 | 2566,90 |
Transmisión de calor[editar]
El calor puede ser transmitido de tres formas distintas: por conducción, por convección o por radiación.
- Conducción térmica: es el proceso que se produce por contacto térmico entre dos ó más cuerpos, debido al contacto directo entre las partículas individuales de los cuerpos que están a diferentes temperaturas, lo que produce que las partículas lleguen al equilibrio térmico. Ej: cuchara metálica en la taza de té.
- Convección térmica: sólo se produce en fluidos (líquidos o gases), ya que implica movimiento de volúmenes de fluido de regiones que están a una temperatura, a regiones que están a otra temperatura. El transporte de calor está inseparablemente ligado al movimiento del propio medio. Ej.: los calefactores dentro de la casa.
- Radiación térmica: es el proceso por el cual se transmite a través de ondas electromagnéticas. Implica doble transformación de la energía para llegar al cuerpo al que se va a propagar: primero de energía térmica a radiante y luego viceversa. Ej.: La energía solar.
La conducción pura se presenta sólo en materiales sólidos. La convección siempre está acompañada de la conducción, debido al contacto directo entre partículas de distinta temperatura en un líquido o gas en movimiento. En el caso de la conducción, la temperatura de calentamiento depende del tipo de material, de la sección del cuerpo y del largo del cuerpo. Esto explica por qué algunos cuerpos se calientan más rápido que otros a pesar de tener exactamente la misma forma, y que se les entregue la misma cantidad de calor.
- Conductividad térmica
La conductividad térmica de un cuerpo está dada por:
donde:
 es el calor entregado,
es el calor entregado,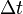 es el intervalo de tiempo durante el cual se entregó calor,
es el intervalo de tiempo durante el cual se entregó calor,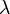 es el coeficiente de conductividad térmica propio del material en cuestión,
es el coeficiente de conductividad térmica propio del material en cuestión, es la sección del cuerpo,
es la sección del cuerpo, es la longitud, y
es la longitud, y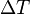 es el incremento en la temperatura.
es el incremento en la temperatura.
Medida experimental del calor[editar]
Para determinar, de manera directa, el calor que se pone de manifiesto en un proceso de laboratorio, se suele emplear un calorímetro. En esencia, se trata de un recipiente que contiene el líquido en el que se va a estudiar la variación de energía por transferencia de calor y cuyas paredes y tapa (supuestamente adiabáticas) deben aislarlo, al máximo, del exterior.
Un termo de paredes dobles de vidrio, cuyas superficies han sido previamente metalizadas por deposición y que presenta un espacio vacío entre ellas es, en principio, un calorímetro aceptable para una medida aproximada de la transferencia de calor que se manifiesta en una transformación tan sencilla como esta. El termo se llama vaso Dewar y lleva el nombre del físico y químico escocés James Dewar, pionero en el estudio de las bajas temperaturas. En la tapa aislante suele haber un par de orificios para introducir untermómetro con el que se evaluaría el incremento (o decremento) de la temperatura interior del líquido, y un agitador para tratar de alcanzar el equilibrio térmico en su interior lo más rápido posible, usando un sencillo mecanismo de convección forzada.
No sólo el líquido contenido en el calorímetro absorbe calor, también lo absorben las paredes del calorímetro. Lo mismo sucede cuando pierde calor. Esta intervención del calorímetro en el proceso se representa por su equivalente en agua. La presencia de esas paredes, no ideales, equivale a añadir al líquido que contiene, los gramos de agua que asignamos a la influencia del calorímetro y que llamamos "equivalente en agua". El "equivalente en agua" viene a ser "la cantidad de agua que absorbe o desprende el mismo calor que el calorímetro".
Unidades de medida[editar]
La unidad de medida del calor en el Sistema Internacional de Unidades es la misma que la de la energía y el trabajo: el Joule.
Otra unidad ampliamente utilizada para medir la cantidad de energía térmica intercambiada es la caloría (cal), que es la cantidad de energía que hay que suministrar a ungramo de agua para elevar su temperatura 1 °C. Diferentes condiciones iniciales dan lugar a diferentes valores para la caloría. La caloría también es conocida como caloría pequeña, en comparación con la kilocaloría (kcal), que se conoce como caloría grande y es utilizada en nutrición.
Joule, tras múltiples experimentaciones en las que el movimiento de unas palas, impulsadas por un juego de pesas, se movían en el interior de un recipiente con agua, estableció el equivalente mecánico del calor, determinando el incremento de temperatura que se producía en el fluido como consecuencia de los rozamientos producidos por la agitación de las palas:
El BTU (unidad térmica británica), es una medida para el calor muy usada en Estados Unidos de América y en muchos otros países de América. Se define como la cantidad de calor que se debe agregar a una libra de agua para aumentar su temperatura en un grado Fahrenheit' y equivale a 252 calorías.
Termodinámica y transferencia de calor[editar]
La termodinámica se interesa en la cantidad de transferencia de calor a medida que un sistema pasa por un proceso, sin indicar cuánto tiempo transcurrirá. Un estudio termodinámico sencillamente nos dice cuánto calor debe transferirse para que se realice un cambio de estado específico, con el fin de cumplir con el principio de conservación de la energía. En la experiencia nos enfocamos más en la velocidad de la transferencia de calor que en la cantidad transferida. La termodinámica trata de los estados en equilibrio y de los cambios que ocurren entre un estado de equilibrio y otro. Por otra parte, la transferencia de calor se ocupa de los sistemas en los que se presenta desequilibrio térmico y, por tanto, existe una condición de no equilibrio. En consecuencia, el estudio de la transferencia de calor no puede basarse sólo en los principios de la termodinámica; sin embargo, existen leyes de la termodinámica que constituyen la base científica de la transferencia de calor.
La primera ley de la termodinámica establece que la velocidad de transferencia de energía hacia un sistema es igual a la velocidad de incremento de la energía de dicho sistema. Su segunda ley, establece que el calor se transfiere en dirección de la temperatura decreciente. El requisito básico para la transferencia de calor es la presencia de una diferencia de temperatura. No existe la más mínima posibilidad de que se dé transferencia neta de calor entre dos medios que están a la misma temperatura, esta diferencia de temperaturas constituye la condición básica necesaria para que se dé transferencia de calor.
Anteriormente mencionamos que el análisis termodinámico no se ocupa de la velocidad de la transferencia de calor en cierta dirección pero, ahora, podemos decir que este parámetro depende de la magnitud del gradiente de temperatura (o diferencia de temperatura por unidad de longitud, o la razón o relación de cambio de la temperatura en esa dirección). A mayor gradiente de temperatura, mayor es la velocidad de transferencia de calor.
Áreas de aplicación de la transferencia de calor[editar]
Es común encontrar la transmisión de calor en los sistemas de ingeniería y otros aspectos de la vida; y no es necesario ir muy lejos para ver algunas de sus áreas de aplicación. Es más, uno de los ejemplos más sencillos lo encontramos dentro del cuerpo humano, éste permanece emitiendo calor en forma constante hacia sus alrededores y la comunidad humana está íntimamente influenciada por la velocidad de esta emisión de calor. Tratamos de controlar la velocidad de esta transferencia de calor al ajustar nuestra ropa a las condiciones ambientales. Muchos aparatos domésticos se han diseñado, en su totalidad o en parte, aplicando los principios de la transferencia de calor. Algunos ejemplos incluyen la estufa eléctrica o de gas, el sistema de calefacción o de acondicionamiento del aire. La transferencia de calor desempeña un papel importante en el diseño de muchos otros aparatos, como los radiadores de automóviles, los colectores solares, diversos componentes de las plantas generadoras de energía e, incluso, las naves espaciales.
Transferencia de calor en la ingeniería[editar]
Los problemas de capacidad nominal se ocupan de la determinación de la velocidad de transferencia de calor para un sistema existente con una diferencia específica de temperatura. Los problemas de dimensionamiento se ocupan de la determinación del tamaño de un sistema con el fin de transferir calor a una velocidad determinada para una diferencia específica de la temperatura. Un proceso o un equipo de transferencia de calor puede ser analizado de forma experimental o de forma analítica. El procedimiento experimental tiene la ventaja de tratar con el sistema físico real y, gracias a ello, la cantidad deseada se determina mediante medición, dentro de los límites del error experimental. El procedimiento analítico tiene la ventaja de que es rápido y barato, pero los resultados obtenidos dependen de la exactitud de las hipótesis e idealizaciones establecidas en el análisis. En los estudios de transferencia de calor a menudo se logra una buena aproximación reduciendo, mediante el análisis, las opciones a solo unas cuantas y, a continuación, verificando los hallazgos experimentalmente.
Sensación de calor en el ser humano[editar]
Generalmente en la mayoría de los países, se habla ya de calor cuando la temperatura supera los 26 ºC en cualquier hora del día, aunque varía mucho según la estación del año en que se encuentre una persona. Por ejemplo, 20 ºC en verano es considerado una temperatura fresca, mientras que en invierno, esta temperatura es considerada templada o cálida.
El fenómeno "ola de calor" se da cuando las temperaturas diurnas superan los 32 ºC y las nocturnas (o al amanecer) no bajan de los 23 ºC por tres días y es común en casi todo tipo de climas en época veraniega, a excepción de los países cerca de los polos, con clima templado y polar, cuando es muy infrecuente o casi nulo, y se hace más frecuente cuando los países están más cerca de los trópicos (países con climas tropical y subtropical). Esta denominación de ola de calor no quiere decir necesariamente calor excesivo ni temperaturas inusuales para la estación; pretende alertar sobre consecuencias perjudiciales en personas o colectivos vulnerables.
El ser humano siente más calor cuando hay más humedad en el ambiente. Por ejemplo, una temperatura de 30 ºC, pero con humedad ambiental del 10 %, se sentirá como si el ambiente fuese de solo 28 ºC. Pero con humedad ambiental del 90 %, se sentirá como si el ambiente fuese de 40 ºC.
Problema 1
En un vaso de cobre, que pesa 1.5 kg, contiene un bloque de hielo de 10 kg a la temperatura de -10 ºC, se inyecta 5 kg de vapor de agua a 100 ºC.
- Determinar el estado de la mezcla.
- Determinar la variación de entropía
Calor específico del cobre 397 J/(kg·K). Calor de fusión del hielo 334 400 J/kg. Calor específico del agua 4180 J/(kg·K). Calor específico del hielo 2090 J/(kg·K).Calor de licuefacción del vapor del agua 2 257 200 J/kg.
 Solución
Solución
Calor necesario para convertir 10 kg de hielo a -10 ºC en agua a 100 ºC
10·2090·10+10·334 400+10·4180·100=7 733 000
Calor necesario para elevar la temperatura de 1.5 kg de cobre de -10 ºC a 100 ºC
1.5·397·110=65 505
Total: 7 733 000+65 505=7 798 505 J
Masa de agua condensada
El resto 1.54 kg queda como vapor.
Entropía
Variación de entropía cuando el agua cambia de temperatura.
Variación de entropía cuando se convierten 10 kg de hielo a -10 ºC en agua a 100 ºC.
Variación de entropía cuando se eleva la temperatura de 1.5 kg de cobre de -10 ºC a 100 ºC
Total: 26370 J/K
Variación de entropía cuando se condensa una masa de 3.45 kg de vapor de agua
La variación total de entropía es ΔS=26370-20907=5463 J/K
Problema 2
Un trozo de hielo de 583 cm3 a 0 ºC se calienta y se convierte en agua a 4 ºC. Calcular
- el incremento de energía interna
- el incremento de entropía que ha experimentado.
Datos: densidad del hielo 0.917 g/cm3, del agua 1 g/cm3, calor de fusión del hielo 80 cal/g. 1 atm=101 293 Pa. 1 cal=4.186 J
TEMA 2

Cantidad de calor |
 |
| Calor: una forma de energía. |
Cuando una sustancia se está fundiendo o evaporándose está absorbiendo cierta cantidad de calor llamada calor latente de fusión o calor latente de evaporación, según el caso. El calor latente, cualquiera que sea, se mantiene oculto, pero existe aunque no se manifieste un incremento en la temperatura,ya que mientras dure la fundición o la evaporación de la sustancia no se registrará variación de la misma.
Para entender estos conceptos se debe conocer muy bien la diferencia entrecalor y temperatura.
En tanto el calor sensible es aquel que suministrado a una sustancia eleva su temperatura.
La experiencia ha demostrado que la cantidad de calor tomada (o cedida) por un cuerpo es directamente proporcional a su masa y al aumento (o disminución) de temperatura que experimenta.
La expresión matemática de esta relación es la ecuación calorimétrica:
Q = m·Ce·(Tf-Ti)
En palabras más simples, la cantidad de calor recibida o cedida por un cuerpo se calcula mediante esta fórmula, en la cual m es la masa, Ce es el calor específico, Ti es la temperatura inicial y Tf la temperatura final. Por lo tanto Tf – Ti = ΔT (variación de temperatura).
Nota: La temperatura inicial (Ti) se anota también como T0 o como t0.
Si Ti > Tf el cuerpo cede calor Q < 0
Si Ti < Tf el cuerpo recibe calor Q > 0
Se define calor específico (Ce) como la cantidad de calor que hay que proporcionar a un gramo de sustancia para que eleve su temperatura en un grado centígrado. En el caso particular del agua Ce vale 1 cal/gº C ó 4,186 J.
(Ver Tabla de calor específico para algunas sustancias)
Ver: Equilibrio térmico
El calor específico puede deducirse de la ecuación anterior. Si se despeja Ce de ella resulta:
El calor específico puede deducirse de la ecuación anterior. Si se despeja Ce de ella resulta:

 |
| Si a 1 kg de hielo (a 0º C) le aplicamos 80 kcal obtendremos 1 kg de agua a 0º C. |
Calor latente de fusión
Para que un sólido pase al estado líquido debe absorber la energía necesaria a fin de destruir las uniones entre sus moléculas. Por lo tanto, mientras dura la fusión no aumenta la temperatura. Por ejemplo, para fundir el hielo o congelar el agua sin cambio en la temperatura, se requiere un intercambio de 80 calorías por gramo, o 80 kilocalorías por kilogramo.
El calor requerido para este cambio en el estado físico del agua sin que exista variación en la temperatura recibe el nombre de calor latente de fusión o simplemente calor de fusión del agua.
Esto significa que si sacamos de un congelador cuya temperatura es de –6° C un pedazo de hielo de masa igual a 100 gramos y lo ponemos a la intemperie, el calor existente en el ambiente elevará la temperatura del hielo, y al llegar a 0° C y seguir recibiendo calor se comenzará a fundir.
A partir de ese momento todo el calor recibido servirá para que la masa de hielo se transforme en agua líquida. Como requiere de 80 calorías por cada gramo (ver cuadro), necesitará recibir 8.000 calorías del ambiente para fundirse completamente. Cuando esto suceda, el agua se encontrará aún a 0° C y su temperatura se incrementará sólo si se continúa recibiendo calor, hasta igualar su temperatura con el ambiente.
Calor de fusión de cada sustancia
El calor de fusión es una propiedad característica de cada sustancia, pues según el material de que esté hecho el sólido requerirá cierta cantidad de calor para fundirse. Por definición: el calor latente de fusión de una sustancia es la cantidad de calor que requiera ésta para cambiar 1 gramo de sólido a 1 gramo de líquido sin variar su temperatura.
Los cálculos pertinentes se realizan utilizando las fórmulas:

Donde λf = calor latente de fusión en cal/gramo.
Q = calor suministrado en calorías.
m = masa de la sustancia en gramos.
En el cuadro siguiente se dan algunos valores del calor latente de fusión para diferentes sustancias.
Sustancia λf en cal/gr.
Agua 80
Hierro 6
Cobre 42
Plata 21
Platino 27
Oro 16
Mercurio 2,8
Plomo 5,9
Agua 80
Hierro 6
Cobre 42
Plata 21
Platino 27
Oro 16
Mercurio 2,8
Plomo 5,9
 |
| Calor latente de fusión para el agua: 80 cal/g. |
Calor latente de solidificación
Como lo contrario de la fusión es la solidificación o congelación, la cantidad de calor requerida por una sustancia para fundirse, es la misma que cede cuando se solidifica.
Por lo tanto, con respecto a una sustancia el calor latente de fusión es igual al calor latente de solidificación o congelación.
Ejercicio 1
Calcular la cantidad de calor que se requiere para transformar 100 gramos de hielo que están a –15° C de temperatura en agua a 0° C.
Desarrollo
Para que el hielo eleve su temperatura de –15° C hasta el punto de fusión a 0° C, se necesita una cantidad de calor que se calcula con la ecuación
Q = m Ce ΔT.
Donde
Q = calor requerido (en calorías)
Ce = Calor específico (en cal/gº C)
ΔT = variación de temperatura o Tf – Ti (en grados C)
Q1 = 100 g x 0,50 cal/g° C x 15° C = 750 calorías.
 |
| Todo líquido calentado hierve. |
Luego, para que el hielo se funda y se tenga agua a 0° C, se aplica la ecuación
Q = mλf (el calor latente de fusión para el agua, según el cuadro anterior, es 80 cal/g) entonces:
Q2 = 100 gr x 80 cal/gr = 8.000 cal
Así, el calor total requerido es:
Q1 + Q2 = 750 cal + 8.000 cal = 8.750 calorías.
Calor latente de vaporización
A una presión determinada todo líquido calentado hierve a una temperatura fija que constituye su punto de ebullición. Este se mantiene constante independientemente del calor suministrado al líquido, pues si se le aplica mayor cantidad de calor, habrá mayor desprendimiento de burbujas sin cambio en la temperatura del mismo.
Cuando se produce la ebullición se forman abundantes burbujas en el seno del líquido, las cuales suben a la superficie desprendiendo vapor.
Si se continúa calentando un líquido en ebullición, la temperatura ya no sube, esto provoca la disminución de la cantidad del líquido y aumenta la de vapor.
Al medir la temperatura del líquido en ebullición y la del vapor se observa que ambos estados tienen la misma temperatura; es decir; coexisten en equilibrio termodinámico.
A presión normal (1 atm = 760 mm de Hg), el agua ebulle (hierve) y el vapor se condensa a 100° C, a esta temperatura se le da el nombre de punto de ebullición del agua. Si se desea que el agua pase de líquido a vapor o viceversa sin variar su temperatura, necesita un intercambio de 540 calorías por cada gramo. Este calor necesario para cambiar de estado sin variar de temperatura se llama calor latente de vaporización del agua o simplemente calor de vaporización.
Ver: PSU: Física; Pregunta 15_2005(1)
 |
| Ebullición natural. |
Por definición el calor latente de vaporización de una sustancia es la cantidad de calor que requiere para cambiar 1 gramo de líquido en ebullición a 1 gramo de vapor, manteniendo constante su temperatura.
Los cálculos pertinentes se realizan utilizando las fórmulas:

Donde
λv = calor latente de vaporización en cal/g
Q = calor suministrado en calorías
m = masa de la sustancia en gramos.
Como lo contrario de la evaporación es la condensación, la cantidad de calor requerida por una sustancia para evaporarse es igual a la que cede cuando se condensa, por lo tanto, en ambos el calor latente de condensación es igual al calor latente de vaporización para dicha sustancia.
En el cuadro siguiente se dan valores del calor latente de vaporización de algunas sustancias.
Calor latente de vaporización de algunas sustancias
Sustancia λv en cal/gr
Agua 540
Nitrógeno 48
Helio 6
Aire 51
Mercurio 65
Alcohol etílico 204
Bromo 44
Agua 540
Nitrógeno 48
Helio 6
Aire 51
Mercurio 65
Alcohol etílico 204
Bromo 44
Ejercicio 2
Calcular la cantidad de calor que se requiere para cambiar 100 gramos de hielo a –0° C en vapor a 130° C.
Desarrollo
Para que el hielo eleve su temperatura de –10° C hasta el punto de fusión a 0° C necesita una cantidad de calor igual a:
Q1 = m CeΔT = 100 g x 0,50 cal/g° C x 10° C = 500 cal.
En seguida, para calcular el calor que se requiere para que el hielo se funda y se tenga agua a 0° C, se aplica la ecuación
Q = mλf.
Q2 = 100 g x 80 cal/g = 8.000 cal.
Agua en ebullición
Siguiendo con el ejercicio, el calor que requiere el agua a fin de elevar su temperatura de 0° C hasta el punto de ebullición de 100° C, se calcula con la ecuación
Q = m CeΔT
Q3 = 100 g x 1 cal/g°C x 100 ° C = 10.000 calorías.
Ahora, para calcular el calor necesario para vaporizar el agua a 100° C se utiliza la ecuación: Q = mλv
Q4 = 100 gr x 540 cal/g = 54.000 cal.
 |
| Agua en ebullición (hirviendo). |
Vapor de agua
El vapor de agua obtenido se mantiene a 100º C (está en equilibrio térmico), pero si quisiéramos aumentar esa temperatura, por ejemplo, hasta 130º C, el calor que se necesita para calentar el vapor desde 100° C hasta 130° C se calcula mediante la ecuación:
Q = m CeΔT
Q5 = 100 gr x 0,499 cal/g° C x 30° C = 1.497 calorías.
En resumen, el calor total que se requiere para transformar 100 gramos de hielo a –10° C de temperatura en vapor a 130° C se encuentra sumando todos los calores aplicados:
QT = Q1+ Q2+ Q3+ Q4+ Q5 = QT = 500 cal + 8.000 cal + 10.000 cal + 54.000 cal + 1.497 cal = 73.997 cal.
Equipo 2
Procesos Termodinamicos
PROCESOS TERMODINAMICOS
Se define como el campo de la física
que describe y relaciona las propiedades físicas de sistemas macroscópicos de
materia y energía. Los principios de la termodinámica tienen una importancia
fundamental para todas las ramas de la ciencia y la ingeniería.
que describe y relaciona las propiedades físicas de sistemas macroscópicos de
materia y energía. Los principios de la termodinámica tienen una importancia
fundamental para todas las ramas de la ciencia y la ingeniería.
Un concepto esencial de la termodinámica es el de sistema macroscópico, que se define como un conjunto de
materia que se puede aislar espacialmente y que coexiste con un entorno
infinito e imperturbable. El estado de un sistema macroscópico en equilibrio
puede describirse mediante propiedades medibles como la temperatura, la presión
o el volumen, que se conocen como variables termodinámicas. Es posible identificar
y relacionar entre sí muchas otras variables (como la densidad, el calor
específico, la compresibilidad o el coeficiente de expansión térmica), con lo
que se obtiene una descripción más completa de un sistema y de su relación con
el entorno.
materia que se puede aislar espacialmente y que coexiste con un entorno
infinito e imperturbable. El estado de un sistema macroscópico en equilibrio
puede describirse mediante propiedades medibles como la temperatura, la presión
o el volumen, que se conocen como variables termodinámicas. Es posible identificar
y relacionar entre sí muchas otras variables (como la densidad, el calor
específico, la compresibilidad o el coeficiente de expansión térmica), con lo
que se obtiene una descripción más completa de un sistema y de su relación con
el entorno.
Cuando un sistema macroscópico pasa de
un estado de equilibrio a otro, se dice que tiene lugar un proceso
termodinámico. Las leyes o principios de la termodinámica, descubiertos en el
siglo XIX a través de meticulosos experimentos, determinan la naturaleza y los límites
de todos los procesos termodinámicos.
un estado de equilibrio a otro, se dice que tiene lugar un proceso
termodinámico. Las leyes o principios de la termodinámica, descubiertos en el
siglo XIX a través de meticulosos experimentos, determinan la naturaleza y los límites
de todos los procesos termodinámicos.
En física, se denomina proceso termodinámico a la evolución de
determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a
un determinado sistema físico. Desde el punto de vista de la termodinámica,
estas transformaciones deben transcurrir desde un estado de equilibrio inicial
a otro final; es decir, que las magnitudes que sufren una variación al pasar de
un estado a otro deben estar perfectamente definidas en dichos estados inicial
y final. De esta forma los procesos termodinámicos pueden ser interpretados
como el resultado de la interacción de un sistema con otro tras ser eliminada
alguna ligadura entre ellos, de forma que finalmente los sistemas se encuentren
en equilibrio (mecánico, térmico y/o material) entre sí.
determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a
un determinado sistema físico. Desde el punto de vista de la termodinámica,
estas transformaciones deben transcurrir desde un estado de equilibrio inicial
a otro final; es decir, que las magnitudes que sufren una variación al pasar de
un estado a otro deben estar perfectamente definidas en dichos estados inicial
y final. De esta forma los procesos termodinámicos pueden ser interpretados
como el resultado de la interacción de un sistema con otro tras ser eliminada
alguna ligadura entre ellos, de forma que finalmente los sistemas se encuentren
en equilibrio (mecánico, térmico y/o material) entre sí.
De una manera menos abstracta, un proceso termodinámico puede ser
visto como los cambios de un sistema, desde unas condiciones iniciales hasta
otras condiciones finales, debidos a la desestabilización del sistema.
visto como los cambios de un sistema, desde unas condiciones iniciales hasta
otras condiciones finales, debidos a la desestabilización del sistema.
PROCESO
ISOTÉRMICO
ISOTÉRMICO
Se denomina proceso isotérmico o proceso isotermo al cambio de temperatura reversible en un sistema termodinámico, siendo dicho cambio de temperatura constante en todo el sistema.
La compresión o expansión de un gas ideal en
contacto permanente con un termostato es un ejemplo de proceso isotermo, y puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de capacidad calorífica muy grande y a la misma temperatura que el gas; este otro sistema se conoce como foco caliente. De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo. Como la
energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W.
contacto permanente con un termostato es un ejemplo de proceso isotermo, y puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de capacidad calorífica muy grande y a la misma temperatura que el gas; este otro sistema se conoce como foco caliente. De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo. Como la
energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W.
Ejemplo de este tipo de proceso, son el de evaporación del agua y la
fusión del hielo. Pues estos tienen un cambio de temperatura, que es constante,
por lo que se le puede llamar, proceso isotérmico.
fusión del hielo. Pues estos tienen un cambio de temperatura, que es constante,
por lo que se le puede llamar, proceso isotérmico.
Un proceso isobárico es
un proceso termodinámico que
ocurre a presión constante. En él, el calor transferido a presión constante está relacionado con el resto de variables mediante:
,
Donde:
= Calor transferido.
= Energía Interna.
= Presión.
= Volumen.
En un diagrama P-V, un proceso isobárico aparece como una línea
horizontal. Si la presión no cambia
durante un proceso, se dice que éste es isobárico.
Un ejemplo de un proceso isobárico:
Es la ebullición del agua en un recipiente abierto. Como el
contenedor está abierto, el proceso se efectúa a presión atmosférica constante.
En el punto de ebullición, la temperatura del agua no aumenta con la adición de
calor, en lugar de esto, hay un cambio de fase de agua a vapor.
Un proceso isocórico, también llamado proceso isométrico o
isovolumétrico es un proceso termodinámico en el cual el volumen permanece constante; ΔV = 0. Esto implica que el
proceso no realiza trabajo presión-volumen, ya que éste se define
como: Z=PΔV; donde P es la presión (el
trabajo es positivo, ya que es ejercido por el sistema).
isovolumétrico es un proceso termodinámico en el cual el volumen permanece constante; ΔV = 0. Esto implica que el
proceso no realiza trabajo presión-volumen, ya que éste se define
como: Z=PΔV; donde P es la presión (el
trabajo es positivo, ya que es ejercido por el sistema).
Aplicando la primera ley de la termodinámica, podemos
deducir que Q, el cambio de la energía interna del sistema es: Q=ΔU, para un
proceso isocórico: es decir, todo el calor que
transfiramos al sistema quedará a su energía interna, U. Si la cantidad de gas permanece
constante, entonces el incremento de energía será proporcional al incremento detemperatura,
Q=nCVΔT, donde CV es el calor específico molar a volumen constante.
deducir que Q, el cambio de la energía interna del sistema es: Q=ΔU, para un
proceso isocórico: es decir, todo el calor que
transfiramos al sistema quedará a su energía interna, U. Si la cantidad de gas permanece
constante, entonces el incremento de energía será proporcional al incremento detemperatura,
Q=nCVΔT, donde CV es el calor específico molar a volumen constante.
En un diagrama P-V, un proceso isocórico aparece como una línea
vertical. Desde el punto de vista de la termodinámica, estas transformaciones
deben transcurrir desde un estado de equilibrio inicial a
otro final; es decir, que las magnitudes que sufren una variación al pasar de
un estado a otro deben estar perfectamente definidas en dichos estados inicial
y final. De esta forma los procesos termodinámicos pueden ser interpretados
como el resultado de la interacción de un sistema con otro tras ser eliminada
alguna ligadura entre ellos, de forma que finalmente los sistemas se encuentren
en equilibrio (mecánico, térmico y/o material) entre si.
De una manera menos abstracta, un proceso termodinámico puede ser visto como
los cambios de un sistema, desde unas condiciones iniciales hasta otras
condiciones finales, debidos a la desestabilización del sistema.
vertical. Desde el punto de vista de la termodinámica, estas transformaciones
deben transcurrir desde un estado de equilibrio inicial a
otro final; es decir, que las magnitudes que sufren una variación al pasar de
un estado a otro deben estar perfectamente definidas en dichos estados inicial
y final. De esta forma los procesos termodinámicos pueden ser interpretados
como el resultado de la interacción de un sistema con otro tras ser eliminada
alguna ligadura entre ellos, de forma que finalmente los sistemas se encuentren
en equilibrio (mecánico, térmico y/o material) entre si.
De una manera menos abstracta, un proceso termodinámico puede ser visto como
los cambios de un sistema, desde unas condiciones iniciales hasta otras
condiciones finales, debidos a la desestabilización del sistema.
Ejemplo:
¿Cuando se
incrementa la energía interna de 10g de hielo que esta a cero
grados centígrados cuando se transforma en agua manteniendo el volumen constante?
como el proceso es isocorico, ya que no cambia el volumen, entonces w=0 y de acuerdo
con la primera ley de la termodinámica la cantidad de calor ganado por el hielo
es igual al cambio en su energia interna, es decir: Q= ΔU . Ahora bien, el
calor de fusion del hielo es Q=mLf. en donde Lf=80cal/g.
Sustituimos
valores en la relación anterior:
Q=(10g)(80cal/g)=800calpor tanto,
el cambio en la energía interna es:
ΔU=Q=800calel cambio en la energía interna es:
4.19J/1cal=3352J
PROCESO ADIABÁTICO
En termodinámica:
•Dicho de un proceso termodinámico, que seproduce sin intercambio de calor con el
exterior
En Física.
•Que no permite el intercambio de calor
•Que está aislado térmicamente
•Que está totalmente aislado del exterior
Las variaciones de volumen o presión de un cuerpo sinaumento o disminución de calor, es decir, no intercambia calor con su entorno. Un procesoadiabático que es además reversible se conoce comoproceso isotrópico.•Que está aislado térmicamente
•Que está totalmente aislado del exterior
El calentamiento y enfriamiento adiabático son
procesos que comúnmente ocurren
debido al cambio en la presión de un gas.
Esto puede ser cuantificado usando la ley de los gases ideales.
Un gas, al dilatarse adiabáticamente,procesos que comúnmente ocurren
debido al cambio en la presión de un gas.
Esto puede ser cuantificado usando la ley de los gases ideales.
se enfría, pues la cantidad de calor que contiene se reparte en un volumen mayor; por
el contrario, la compresión adiabática
de dicho gas tiene
por efecto un aumento de su temperatura.
en climatización los
procesos de humectación (aporte de vapor de agua) son adiabáticos, puesto que no hay transferencia decalor, a pesar que se consiga variar la temperatura delaire y su humedad relativa.
procesos de humectación (aporte de vapor de agua) son adiabáticos, puesto que no hay transferencia decalor, a pesar que se consiga variar la temperatura delaire y su humedad relativa.
Límite adiabático:
Se dice que un límite es adiabáticocuando el estado del sistema se puede cambiar únicamente moviendo el límite o
bien colocando al sistema en un campo de fuerzas exteriores (por ejemplo campos
eléctricos, magnéticos o gravitacionales). Esta noción será crucial en nuestra
próxima formulación de la Primera Ley. A veces se suele definir el límite
adiabático como aquél que es impermeable al flujo de calor.
PROCESO DIATÉRMICO
Se le llama Diatérmico a aquel cuerpo que deja pasar fácilmente calor.
límite diatérmico:Se dice que un límite es diatérmico cuando permite que el estado del sistema se
modifique sin que haya movimiento del límite. La manera usual de definirlo es
que un límite es diatérmico cuando permite el flujo de calor a través de él.
Paredes diatérmicas:
Son aquellas que sí permiten que un sistema termodinámico modifique su grado
relativo de calentamiento.
Problemas resueltos de termodinámica
b. ¿Es posible transformar todo el calor en trabajo en un ciclo? Razona la respuesta.
c. ¿En qué casos se mantiene constante la temperatura de un cuerpo al que suministramos calor?
- Determinar el estado de la mezcla.
- Determinar la variación de entropía
Calor específico del cobre 397 J/kg ºK. Calor de fusión del hielo 334 400 J/kg. Calor específico del agua 4180 J/kg ºK. Calor específico del hielo 2090 J/kg ºK.Calor de licuefación del vapor del agua 2 257 200 J/kg.
Datos: densidad del hielo 0.917 gr/cm3, del agua 1 gr/cm3, calor de fusión del hielo 80 cal/g.
 | Cuando un sistema pasa del estado a al b a lo largo de la transformación acb recibe una cantidad de calor de 20000 cal y realiza 7.500 cal de trabajo. |
- ¿Cuánto calor recibe el sistema a lo largo de la transformación adb, si el trabajo es de 2500 cal?
- Cuando el sistema vuelve de b hacia a, a lo largo de la transformación en forma de curva, el trabajo es de 5000 cal. ¿Cuánto calor absorbe o libera el sistema?
- Si Ua=0 y Ud=10000 cal hállese el calor absorbido en los procesos ad y db.
Nota: no hace falta ningún dato de p y V para resolver el problema
- A ® B: Transformación isoterma reversible siendo VB=2 10-2 m3
- B ® C: Transformación isócora (V=cte) reversible siendo TC=189 K
- C ® A: Transformación adiabática reversible, que devuelve al gas a sus condiciones iniciales.
a) Determinar el número de moles de helio, confeccionar una tabla en la que aparezcan los valores P, V y T en los tres estados A, B y C, y dibujar el ciclo en el diagrama P-V.
b) Calcular, en unidades del sistema internacional, de forma directa (siempre que sea posible) el trabajo W, el calor Q, y la variación de energía interna DU, del gas para cada uno de los procesos.
c) Determinar el rendimiento de este ciclo como motor térmico y comparar el resultado con el de un motor de Carnot que funcione entre las dos temperaturas extremas del ciclo.
Dato: R=8.33 J/(mol K)
 |
Una máquina térmica trabaja con 3 moles de un gas monoatómico, describiendo el ciclo reversible ABCD de la figura. Sabiendo que VC = 2 VB:
• El rendimiento del ciclo. |
R=0.082 atm l/mol K; 1cal=4.186J; 1atm=1.013 105 Pa, cv=3R/2
- Representar gráficamente este ciclo en un diagrama P-V.
- Calcular el valor de las variables termodinámicas desconocidas en los vértices A, B, C y D.
- Hallar el calor, el trabajo, la variación de energía interna, en Joules, de forma directa y/o empleando el Primer Principio, en cada etapa del ciclo.
- Calcular el rendimiento.
R= 0.082 atm l/(mol K) = 8.314 J/(mol K) ; 1 cal = 4.186 J; 1atm = 1.013 105 Pa
En el ciclo de la figura que describe un gas ideal monoatómico
|
TEMA 2
Transferencia de calor
La transferencia de calor es el paso de energía térmica desde un cuerpo de mayor temperatura a otro de menor temperatura. Cuando un cuerpo, por ejemplo, un objeto sólido o un fluido, está a una temperatura diferente de la de su entorno u otro cuerpo, la transferencia de energía térmica, también conocida como transferencia de calor o intercambio de calor, ocurre de tal manera que el cuerpo y su entorno alcancen equilibrio térmico. La transferencia de calor siempre ocurre desde un cuerpo más caliente a uno más frío, como resultado del segundo principio de la termodinámica. Cuando existe una diferencia de temperatura entre dos objetos en proximidad uno del otro, la transferencia de calor no puede ser detenida; solo puede hacerse más lenta.
Índice
[ocultar]Modos de transferencia[editar]
Los modos de transferencia son diferentes procesos de transporte de calor, usualmente se agrupan en tres tipos según haya también transferencia o no transferencia de materia (o fotones)como los siguientes :
- Conducción: Es la transferencia de calor que se produce a través de un medio estacionario -que puede ser un sólido- cuando existe una diferencia de temperatura.
- Convección: La convección es una de las tres formas de transferencia de calor y se caracteriza porque se produce por medio de un fluido (líquido o gas) que transporta el calor entre zonas con diferentes temperaturas. La convección se produce únicamente por medio de materiales fluidos. Lo que se llama convección en sí, es el transporte de calor por medio del movimiento del fluido, por ejemplo: al trasegar el fluido por medio de bombas o al calentar agua en una cacerola, la que está en contacto con la parte de abajo de la cacerola se mueve hacia arriba, mientras que el agua que está en la superficie, desciende, ocupando el lugar que dejó la cacerola caliente.
- Radiación: se puede atribuir a cambios en las configuraciones electrónicas de los átomos o moléculas constitutivas. En ausencia de un medio, existe una transferencia neta de calor por radiación entre dos superficies a diferentes temperaturas, debido a que todas las superficies con temperatura finita emiten energía en forma de ondas electromagnéticas.1
Aislamiento y barreras de radiación[editar]
Los aislantes térmicos son materiales específicamente diseñados para reducir el flujo de calor limitando la conducción, convección o ambos. Las barreras de radiación, son materiales que reflejan la radiación, reduciendo así el flujo de calor de fuentes de radiación térmica. Los buenos aislantes no son necesariamente buenas barreras de radiación, y viceversa. Los metales, por ejemplo, son excelentes reflectores pero muy malos aislantes.
La efectividad de un aislante está indicado por su resistencia (R). La resistencia de un material es el inverso del coeficiente de conductividad térmica (k) multiplicado por el grosor (d) del aislante. Las unidades para la resistencia son en el sistema internacional de unidades: (K·m²/W).
La fibra de vidrio rígida, un material aislante usado comúnmente, tiene un valor R de 4 por pulgada, mientras que el cemento, un mal conductor, tiene un valor de 0.08 por pulgada.2
La efectividad de una barrera de radiación está indicado por su reflectividad, la cual es una fracción de la radiación reflejada. Un material con una alta reflectividad (en unalongitud de onda) tiene una alta absorbitividad, y por consiguiente una baja emisividad. Un reflector ideal tiene un coeficiente de reflectividad igual a 1, lo que significa que refleja el 100% de la radiación entrante. Por otro lado, en el caso de un cuerpo negro, el cual tiene una excelente absorbitividad y emitividad de la radiación térmica, su coeficiente de reflectividad es casi 0. Las barreras de radiación tiene una gran aplicación en ingeniería aeroespacial; la gran mayoría de los satélites usan varias capas aislantes aluminizadas que reflejan la luz solar, lo que permite reducir la transferencia de calor y controlar la temperatura del satélite.
Disciplinas académicas[editar]
Los fenómenos de transferencia son generalmente parte del programa de estudios de ingeniería aeroespacial, ingeniería electromecánica, ingeniería industrial, ingeniería química, ingeniería agrícola o ingeniería mecánica. Comúnmente, los conocimientos sobre termodinámica son una condición previa para el estudio de la transmisión de calor, dado que las leyes de la termodinámica son esenciales para comprender el mecanismo de la transferencia de calor. Otras disciplinas relacionadas con la transmisión de calor incluyen la conversión de energía, termofluidos y transferencia de materia.
Los métodos de transferencia de calor se usan en las siguientes disciplinas, entre otras:
- ingeniería de automoción
- sistemas electrónicos
- HVAC
- aislamiento
- procesamiento de materiales
- ingeniería de centrales de energía
Transferencia de CalorLa transferencia de calor se produce normalmente desde un objeto con altatemperatura, a otro objeto con temperatura mas baja. La transferencia de calor cambia la energía interna de ambos sistemas implicados, de acuerdo con la primera ley de la Termodinámica.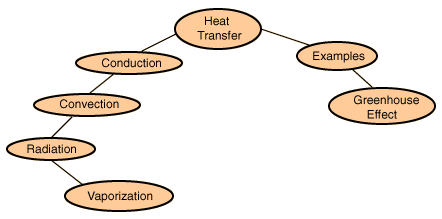
| Índice | ||
| Atrás |
Conducción del CalorLa conducción es la transferencia de calor, por medio de la excitación molecular en el interior del material, sin ningún tipo de movimiento entre los objetos. Si un extremo de una barra de metal está a una temperaturamas alta, entonces se transferirá energía hacia el extremo mas frío, debido a las colisiones de partículas de alta velocidad con las mas lentas, produciéndose una transferencia neta de energía hacia estas últimas. En una transferencia entre dos superficies planas, como la pérdida de calor a través de las paredes de una casa, la tasa de transferencia de calor por conducción es:
| Índice Conceptos sobre Transferencia de Calor Ejemplos sobre Transferencia de Calor | ||||||||||||||||||
| Atrás |
Convección del CalorLa convección es la transferencia de calor por medio del movimiento de una masa fluida, tal como el aire o el agua. Cuando estos se calientan se mueven hacia fuera de la fuente de calor, transportando consigo la energía. La convección por encima de una superficie caliente ocurre porque, cuando se calienta el aire en contacto con la superficie, se expande, se hace menosdenso, y se eleva (ver la ley de gas ideal). De igual manera, el agua caliente es menos densa que la fría y por tanto se eleva, originando corrientes de convección que transportan energía.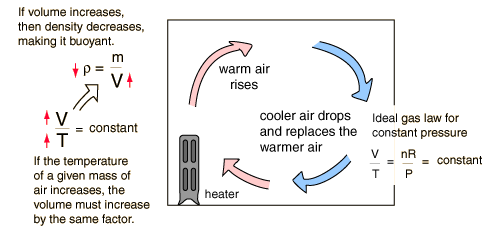
|
Cambio de estado
En física y química se denomina cambio de estado a la evolución de la materia entre varios estados de agregación sin que ocurra un cambio en su composición. Los tres estados más estudiados y comunes en la Tierra son el sólido, el líquido y el gaseoso; no obstante, el estado de agregación más común en el Universo es el plasma, material del que están compuestas las estrellas (si se descarta la materia oscura).
Índice
[ocultar]Cambios de estado de agregación de la materia[editar]
Son los procesos en los que un estado de la materia cambia a otro manteniendo una semejanza en su composición. A continuación se describen los diferentes cambios de estado o transformaciones de fase de la materia:
- Fusión: Es el paso de un sólido al estado líquido por medio del calor; durante este proceso endotérmico (proceso que absorbe energía para llevarse a cabo este cambio) hay un punto en que la temperatura permanece constante. El "punto de fusión" es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cada sustancia. Dichas moléculas se moverán en una forma independiente, transformándose en un líquido. Un ejemplo podría ser un hielo derritiéndose, pues pasa de estado sólido al líquido.
- Solidificación: Es el paso de un líquido a sólido por medio del enfriamiento; el proceso es exotérmico. El "punto de solidificación" o de congelación es la temperatura a la cual el líquido se solidifica y permanece constante durante el cambio, y coincide con el punto de fusión si se realiza de forma lenta (reversible); su valor es también específico.
- Vaporización y ebullición: Son los procesos físicos en los que un líquido pasa a estado gaseoso. Si se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión continuar calentándose el líquido, éste absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión del agua en estado líquido en agua en estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. En ese momento es posible aumentar la temperatura del gas.
- Condensación: Se denomina condensación al cambio de estado de la materia que se pasa de forma gaseosa a forma líquida. Es el proceso inverso a la vaporización. Si se produce un paso de estado gaseoso a estado sólido de manera directa, el proceso es llamado sublimación inversa. Si se produce un paso del estado líquido a sólido se denomina solidificación.
- Sublimación: Es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Al proceso inverso se le denomina Sublimación inversa; es decir, el paso directo del estado gaseoso al estado sólido. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco.
- Desionización: Es el cambio de un plasma a gas.
- Ionización: Es el cambio de un gas a un plasma.
Es importante hacer notar que en todas las transformaciones de fase de las sustancias, éstas no se transforman en otras sustancias, solo cambia su estado físico.
Las diferentes transformaciones de fase de la materia en este caso las del agua son necesarias y provechosas para la vida y el sustento del hombre cuando se desarrollan normalmente.
Los cambios de estado están divididos generalmente en dos tipos: progresivos y regresivos.
- Cambios progresivos: Vaporización, fusión y sublimación progresiva.
- Cambios regresivos: Condensación, solidificación y sublimación regresiva
La siguiente tabla indica cómo se denominan los cambios de estado:
| Inicial\Final | Sólido | Líquido | Gas |
|---|---|---|---|
| Sólido | fusión | sublimación, sublimación progresiva o sublimación directa | |
| Líquido | solidificación | evaporación o ebullición | |
| Gas | sublimación inversa, regresiva o deposición | condensación y licuefacción (licuación) |
También se puede ver claramente con el siguiente gráfico:
Punto de fusión[editar]
El punto de fusión es la temperatura a la cual la materia pasa de estado sólido a estado líquido, es decir, se funde.
Al efecto de fundir un metal se le llama fusión (no podemos confundirlo con el punto de fusión). También se suele denominar fusión al efecto de licuar o derretir una sustancia sólida, congelada o pastosa, en líquida.
En la mayoría de las sustancias, el punto de fusión y de congelación, son iguales. Pero esto no siempre es así: por ejemplo, el agar-agar se funde a 85 °C y se solidifica a partir de los 31 °C a 40 °C; este proceso se conoce como histéresis.
En geología, se denomina punto de solidus a la temperatura en la que empieza a fundirse una roca y punto de liquidus a la temperatura en la que la fusión es total. Tanto la presencia de agua como una disminución de la presión pueden rebajar los puntos de solidus y liquidus de una roca, facilitando la formación de magmas sin aumentar la temperatura.1
Punto de ebullición[editar]
El punto de ebullición es aquella temperatura en la cual la materia cambia de estado líquido a gaseoso, es decir se ebulle. Expresado de otra manera, en un líquido, el punto de ebullición es la temperatura a la cual la presión de vapor del líquido es igual a la presión del medio que rodea al líquido. En esas condiciones se puede formar vapor en cualquier punto del líquido.
La temperatura de una sustancia o cuerpo depende de la energía cinética media de las moléculas. A temperaturas inferiores al punto de ebullición, sólo una pequeña fracción de las moléculas en la superficie tiene energía suficiente para romper la tensión superficial y escapar. Este incremento de energía constituye un intercambio de calor que da lugar al aumento de la entropía del sistema (tendencia al desorden de las partículas que lo componen).
El punto de ebullición depende de la masa molecular de la sustancia y del tipo de las fuerzas intermoleculares de esta sustancia. Para ello se debe determinar si la sustancia es covalente polar, covalente no polar, y determinar el tipo de enlaces (dipolo permanente - dipolo inducido o puentes de hidrógeno).
TEMA 2
Equilibrio térmico
El equilibrio térmico es aquel estado en el cual se igualan las temperaturas de dos cuerpos, las cuales, en sus condiciones iniciales presentaban diferentes temperaturas. Una vez que las temperaturas se equiparan se suspende el flujo de calor, llegando ambos cuerpos al mencionado equilibrio térmico.
Índice
[ocultar]Definición termodinámica del equilibrio térmico[editar]
Para poder dar una definición más precisa del concepto de equilibrio térmico desde un punto de vista termodinámico es necesario definir algunos conceptos.
Dos sistemas que están en contacto mecánico directo o separados mediante una superficie que permite la transferencia de calor lo que se conoce como superficie diatérmica, se dice que están en contacto térmico.
Consideremos entonces dos sistemas en contacto térmico, dispuestos de tal forma que no puedan mezclarse o reaccionar químicamente. Consideremos además que estos sistemas están colocados en el interior de un recinto donde no es posible que intercambien calor con el exterior ni existan acciones desde el exterior capaces de ejercer trabajosobre ellos. La experiencia indica que al cabo de un tiempo estos sistemas alcanzan un estado de equilibrio termodinámico que se denominará estado de equilibrio térmico recíproco o simplemente de equilibrio térmico.
Interpretación microscópica del equilibrio térmico[editar]
La termodinámica proporciona una descripción macroscópica de los sistemas que estudia, sin hacer hipótesis acerca de la estructura microscópica de esos sistemas. Sin embargo, existen otras disciplinas, como la física estadística, que estudian los mismos fenómenos de la Termodinámica, pero desde un enfoque microscópico.
En particular, el concepto de equilibrio térmico está ligado al concepto de temperatura al decir que dos sistemas en equilibrio térmico tienen la misma temperatura. Desde un punto de vista microscópico, la temperatura está asociada a la energía cinética promedio que tienen las partículas que constituyen el sistema, a saber, átomos, moléculas y/o la estructura electrónica de la sustancia que constituye el sistema. Macroscópicamente, esta energía cinética promedio de las partículas de un sistema es lo que en la Termodinámica se llama energía interna, que es una energía que depende casi exclusivamente de la temperatura del sistema. A mayor energía cinética promedio de las partículas que constituyen un sistema, mayor energía interna y, en general, mayor temperatura del sistema.
La situación de dos sistemas en contacto térmico se interpreta microscópicamente como que las partículas de la superficie de interfase de ambos sistemas son capaces de interactuar entre sí. Básicamente se puede ver que, microscópicamente, las partículas del sistema de mayor temperatura (que tienen mayor energía cinética) van a transferir parte de su energía a las partículas del otro sistema. Se encuentra que esta interacción entre los dos sistemas da lugar a que las partículas de los dos sistemas alcancen la misma energía cinética promedio y, por lo tanto, la misma temperatura. Es decir, desde un punto de vista microscópico, se entiende como equilibrio térmico entre dos sistemas que las partículas de los dos sistemas tengan la misma energía cinética promedio.
Desde un punto de vista macroscópico, se dice que los sistemas un estado de equilibrio, bajo las condiciones indicadas en la sección definición termodinámica del equilibrio térmico. En cambio, desde un punto de vista microscópico, el estado de equilibrio se refiere al promedio, ya que los dos sistemas continúan intercambiando energía incluso una vez alcanzado el equilibrio térmico. Sin embargo, la energía cinética individual de una partícula no es estacionaria, sino que es el promedio de la distribución de energías de todas las partículas del sistema lo que no cambia en el tiempo.
De igual manera que para el caso macroscópico, se puede extender el concepto de equilibrio térmico a un único sistema donde, en esa situación de equilibrio, las partículas de dos partes cualesquiera del sistema tienen la misma energía cinética promedio.
Ley Cero de la Termodinámica[editar]
El concepto de equilibrio térmico es la base de la llamada Ley Cero de la Termodinámica. Esta ley proposición fue enunciada por R. H. Fowler en 1931. La ley cero de la termodinámica se enuncia diciendo:
La experiencia indica que si dos sistemas A y B se encuentran, cada uno por separado, en equilibrio térmico con un tercer sistema, que llamaremos C, entonces A y B se encuentran en equilibrio térmico entre sí.
Aplicación del concepto de equilibrio térmico: Termometría[editar]
Para saber la temperatura de una sustancia o cuerpo, se utiliza un dispositivo que permite determinar su propia temperatura. Tal dispositivo se denomina termómetro. Para determinar la temperatura de un cuerpo, se pone un termómetro en contacto térmico con él hasta que ambos alcanzan el equilibrio térmico. Sabemos que en el equilibrio térmico tanto el cuerpo como el termómetro se encuentran a la misma temperatura. Por tanto, la temperatura que indique el termómetro será también la temperatura del cuerpo en cuestión. Se recalca que, lo que un termómetro indica es su propia temperatura, por esto es importante conocer el concepto de equilibrio térmico.
Energía interna
En física, la energía interna (U) de un sistema intenta ser un reflejo de la energía a escala macroscópica. Más concretamente, es la suma de:
- la energía cinética interna, es decir, de las sumas de las energías cinéticas de las individualidades que lo forman respecto al centro de masas del sistema,
- la energía potencial interna, que es la energía potencial asociada a las interacciones entre estas individualidades.1
La energía interna no incluye la energía cinética traslacional o rotacional del sistema como un todo. Tampoco incluye la energía potencial que el cuerpo pueda tener por su localización en un campo gravitacional o electrostático externo.
Si pensamos en constituyentes atómicos o moleculares, será el resultado de la suma de la energía cinética de las moléculas o átomos que constituyen el sistema (de sus energías de traslación, rotación y vibración) y de la energía potencial intermolecular (debida a las fuerzas intermoleculares) e intramolecular de la energía de enlace.
- En un gas ideal monoatómico bastará con considerar la energía cinética de traslación de sus átomos.
- En un gas ideal poliatómico, deberemos considerar además la energía vibracional y rotacional de las mismas.
- En un líquido o sólido deberemos añadir la energía potencial que representa las interacciones moleculares.
Desde el punto de vista de la termodinámica, en un sistema cerrado (o sea, de paredes impermeables), la variación total de energía interna es igual a la suma de las cantidades de energía comunicadas al sistema en forma de calor y de trabajo 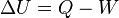 (En termodinámica se considera el trabajo negativo cuando este entra en el sistema termodinámico, positivo cuando sale). Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una función de estado. Del mismo modo
(En termodinámica se considera el trabajo negativo cuando este entra en el sistema termodinámico, positivo cuando sale). Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una función de estado. Del mismo modo 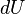 es una diferencial exacta, a diferencia de
es una diferencial exacta, a diferencia de  , que depende del proceso.
, que depende del proceso.
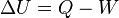 (En termodinámica se considera el trabajo negativo cuando este entra en el sistema termodinámico, positivo cuando sale). Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una función de estado. Del mismo modo
(En termodinámica se considera el trabajo negativo cuando este entra en el sistema termodinámico, positivo cuando sale). Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una función de estado. Del mismo modo 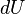 es una diferencial exacta, a diferencia de
es una diferencial exacta, a diferencia de  , que depende del proceso.
, que depende del proceso.Índice
[ocultar]El enfoque termodinámico: la ecuación fundamental[editar]
En termodinámica se deduce la existencia2 de una ecuación de la forma
conocida como ecuación fundamental en representación energética.
La importancia de la misma radica en que concentra en una sola ecuación toda la información termodinámica de un sistema. La obtención de resultados concretos a partir de la misma se convierte entonces en un proceso sistemático.
Si calculamos su diferencial:
se definen sus derivadas parciales:
- la temperatura

- la presión
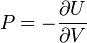
- el potencial químico
 .
.
Como T, P y
 son derivadas parciales de U, serán funciones de las mismas variables que U:
son derivadas parciales de U, serán funciones de las mismas variables que U:
Estas relaciones reciben el nombre de ecuaciones de estado. Por lo general no se dispone de la ecuación fundamental de un sistema. En ese caso sus sustitución por el conjunto de todas las ecuaciones de estado proporcionaría una información equivalente, aunque a menudo debamos conformarnos con un subconjunto de las mismas.
Algunas variaciones de la energía interna[editar]
Al aumentar la temperatura de un sistema, sin que varíe nada más, aumenta su energía interna reflejado en el aumento de la energía térmica del sistema completo o de la materia estudiada.
Convencionalmente, cuando se produce una variación de la energía interna manifestada en la variación del calor que puede ser cedido, mantenido o absorbido se puede medir este cambio en la energía interna indirectamente por la variación de la temperatura de la materia.
Variación sin cambio de estado[editar]
Sin que se modifique el estado de la materia que compone el sistema, se habla de variación de la energía interna sensible o calor sensible y se puede calcular de acuerdo a los siguientes parámetros;
Donde cada término con sus unidades en el Sistema Internacional son:
Q = es la variación de energía o de calor del sistema en un tiempo definido (J).
Ce = calor específico de la materia (J/kg·K).
m = masa.
 = temperatura final del sistema - temperatura inicial (K).
= temperatura final del sistema - temperatura inicial (K).Ejemplo[editar]
Calcular la energía total de un sistema compuesto de 1 g de agua en condiciones normales, es decir a la altura del mar, una atmósfera de presión y a 14 °C para llevarlo a 15º C, sabiendo que el Ce del agua es = 1 [cal/g·°C].
Aplicando la fórmula  y reemplazando los valores, tenemos;
y reemplazando los valores, tenemos;
 y reemplazando los valores, tenemos;
y reemplazando los valores, tenemos;- Q = 1 [cal/g·°C] · 1 [g] · (15 - 14) [°C] = 1 [cal]
Energía cinética media de un gas ideal[editar]

K = Constante de Boltzmann = 1,38·10-23 J/K
 =Velocidad media de la molécula
=Velocidad media de la molécula
Las propiedades termodinámicas de un gas ideal pueden ser descritas por dos ecuaciones:
La ecuación de estado de un gas ideal clásico que es la ley de los gases ideales
y la energía interna a volumen constante de un gas ideal que queda determinada por la expresión:
donde
- P es la presión
- V es el volumen
- n es la cantidad de sustancia de un gas (en moles)
- R es la constante de los gases (8.314 J·K−1mol-1)
- T es la temperatura absoluta
- U es la energía interna del sistema
 es el calor específico adimensional a volumen constante, ≈ 3/2 para un gas monoatómico, 5/2 para un gas diatómico y 3 para moléculas más complejas.
es el calor específico adimensional a volumen constante, ≈ 3/2 para un gas monoatómico, 5/2 para un gas diatómico y 3 para moléculas más complejas.
- N es el número de partículas de gas
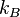 es la constante de Boltzmann (1.381×10−23J·K−1).
es la constante de Boltzmann (1.381×10−23J·K−1).
La distribución de probabilidad de las partículas por velocidad o energía queda determinada por la distribución de Boltzmann.
Variación con modificación de la composición química[editar]
Si se produce alteración de la estructura atómica-molecular, como es el caso de las reacciones químicas o cambio de estado, se habla de variación de la energía internaquímica o variación de la energía interna latente.
Esta condición de cambio de estado se puede calcular de acuerdo a:
Donde  = Coeficiente de cambio de estado, medido en [J/kg]
= Coeficiente de cambio de estado, medido en [J/kg]
 = Coeficiente de cambio de estado, medido en [J/kg]
= Coeficiente de cambio de estado, medido en [J/kg]
Véase también: Entalpía
Variación nuclear[editar]
Energía InternaLa energía interna se define como la energía asociada con el movimiento aleatorio y desordenado de las moléculas. Está en una escala separada de la energía macroscópica ordenada, que se asocia con los objetos en movimiento. Se refiere a la energía microscópica invisible de la escala atómica y molecular. Por ejemplo, un vaso de agua a temperatura ambiente sobre una mesa, no tiene energía aparente, ya sea potencial o cinética. Pero en escala microscópica, es un hervidero de moléculas de alta velocidad que viajan a cientos de metros por segundo. Si el agua se tirase por la habitación, esta energía microscópica no sería cambiada necesariamente por la superimposición de un movimiento ordenada a gran escala, sobre el agua como un todo.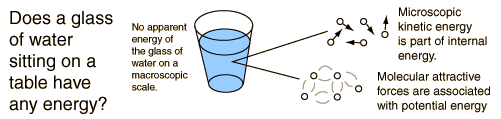 Las cantidades relacionadas con la energía, que son particularmente útiles en la termodinámica química son la entalpía, la energia libre de Helmholtz, y laenergía libre de Gibbs.
| Índice Conceptos sobre Energía Interna | ||||
| Atrás |
Energía MicroscópicaLa energía interna representa energía a escala microscópica. En un gas monoatómico ideal, esto es exactamente, la energía cinética de traslación del movimiento lineal de los átomos tipo "esferas duras". El comportamiento del sistema está bien descrito por la teoría cinética. Sin embargo en los gases poliatómicos, tambien hay energía cinética rotacional y de vibración. Por tanto, en los líquidos y sólidos, hay energía potencial asociada con las fuerzas atractivas intermoleculares. Una visualización simplificada de las contribuciones a la energía interna puede ayudar en el conocimiento de lastransiciones de fases y otros fenómenos que implican a la energía interna.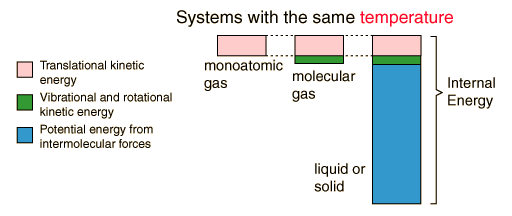
| Índice Conceptos sobre Energía Interna | ||
| Atrás |
Ejemplo de Energía Interna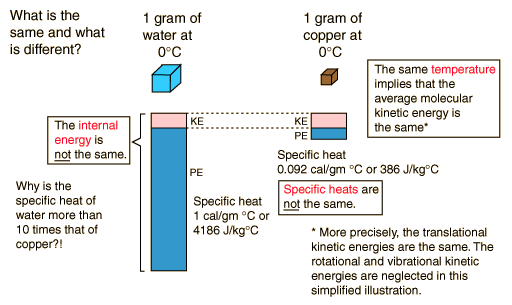
|
TEMA 2
Máquina térmica
Una máquina térmica es un conjunto de elementos mecánicos que permite intercambiar energía, generalmente a través de un eje, mediante la variación de energía de un fluido que varía su densidad significativamente al atravesar la máquina. Se trata de una máquina de fluido en la que varía el volumen específico del fluido en tal magnitud que los efectos mecánicos y los efectos térmicos son interdependientes.
Por el contrario, en una máquina hidráulica, que es otro tipo de máquina de fluido, la variación de densidad es suficientemente pequeña como para poder desacoplar el análisis de los efectos mecánicos y el análisis de los efectos térmicos, llegando a despreciar los efectos térmicos en gran parte de los casos. Tal es el caso de una bomba hidráulica, a través de la cual pasa líquido. Alejándose de lo que indica la etimología de la palabra «hidráulica», también puede considerarse como máquina hidráulica un ventilador, pues, aunque el aire es un fluido compresible, la variación de volumen específico no es muy significativa con el propósito de que no se desprenda la capa límite.
En una máquina térmica, la compresibilidad del fluido no es despreciable y es necesario considerar su influencia en la transformación de energía.
Índice
[ocultar]Máquina térmica y motor térmico[editar]
En un principio se podría definir a una máquina térmica como un dispositivo, equipo o una instalación destinada a la producción de trabajo en virtud de un aporte calórico. Aunque en algunas definiciones se identifican como sinónimos los términos «máquina térmica motora» y «motor térmico», en otras se diferencian ambos conceptos. Al diferenciarlos, se considera que un motor térmico es un conjunto de elementos mecánicos que permite obtener energía mecánica a partir de la energía térmica obtenida mediante una reacciónde combustión o una reacción nuclear. Un motor térmico dispone de lo necesario para obtener energía térmica, mientras que una máquina térmica motora necesita energía térmica para funcionar, mediante un fluido que dispone de más energía a la entrada que a la salida.1
Clasificación[editar]
Según el sentido de transferencia de energía[editar]
Las máquinas térmicas pueden clasificarse, según el sentido de transferencia de energía, en:
- Máquinas térmicas motoras, en las cuales la energía del fluido disminuye al atravesar la máquina, obteniéndose energía mecánica en el eje.
- Máquinas térmicas generadoras, en las cuales la energía del fluido aumenta al atravesar la máquina, precisándose energía mecánica en el eje.
Según el principio de funcionamiento[editar]
Atendiendo al principio de funcionamiento, las máquinas térmicas se clasifican en:
- Máquinas volumétricas o máquinas de desplazamiento positivo, cuyo funcionamiento está basado en principios mecánicos ehidrostáticos, de manera que el fluido en algún instante está contenido en un volumen limitado por los elementos de la máquina. En este tipo de máquinas el flujo es pulsatorio. Se dividen a su vez en dos tipos según el movimiento del órgano propulsor: alternativas, cuyo movimiento es rectilíneo; y rotativas, cuyo movimiento es circular.
- Turbomáquinas, cuyo funcionamiento está basado en el intercambio de cantidad de movimiento entre el fluido y un rodete. En estas máquinas el flujo es continuo.
Teniendo en cuenta lo anterior, podemos clasificar las máquinas térmicas tal como se recoge en el cuadro siguiente.
| Motoras | Volumétricas | Alternativas | Máquina de vapor |
| Rotativas | Motor Wankel | ||
| Turbomáquinas | Turbina | ||
| Generadoras | Volumétricas | Alternativas | Compresor de émbolo |
| Rotativas | Compresor rotativo | ||
| Turbomáquinas | Turbocompresor | ||
Balance de energía en una máquina térmica[editar]
Un sistema abierto es aquel que intercambia materia y energía con el entorno. Aplicando el primer principio de la termodinámica para unsistema abierto, el incremento de energía del sistema en un intervalo de tiempo es:
donde;
- Q es el calor entregado al sistema. Será negativo cuando el calor sea entregado por el sistema.
- W es el trabajo entregado al sistema, en forma de trabajo mecánico y energía de presión. Será negativo cuando el calor sea entregado por el sistema.
- El subíndice in representa la materia que entra al sistema.
- El subíndice out representa la materia que sale del sistema.
- h es la entalpía por unidad de masa del flujo
- V2/2 es la energía cinética por unidad de masa del flujo.
- gz es la energía potencial por unidad de masa del flujo
Haciendo la derivada de la expresión anterior respecto al tiempo, se obtiene:
Debe tenerse en cuenta que en máquinas generadoras, puede aparecer esta expresión con el signo de W cambiado, para que se exprese el trabajo entregado por la máquina y así W sea positivo.
Véase también: Criterio de signos termodinámico
Simplificaciones[editar]
La ecuación que expresa el balance de energía puede simplificarse en los siguientes casos:
- Sistema en reposo
Cuando el sistema está en reposo, tal como en máquinas estacionarias, las variaciones de energía potencial y energía cinética serán nulas.

- Régimen permanente
Cuando la máquina funciona en régimen permanente, las cantidades de masa y energía que entran son iguales a las que salen, pues de lo contrario variarían esa cantidades dentro del sistema.


- Variación de energía potencial despreciable
En la mayoría de las máquinas térmicas, diferencia de energía potencial del flujo que sale respecto al que entra es poco significativo en comparación con los otros términos asociados a la energía del flujo.

- Sistemas adiabáticos
En la mayoría de las máquinas térmicas, la transferencia de calor es despreciable frente a otros intercambios de energía. Teniendo en cuenta la transmisión de calor porconducción y convección:
donde Q es el calor intercambiado, U es el coeficiente global de transferencia de calor, A es la superficie del sistema y  es la diferencia de temperaturas media logarítmica, puede considerarse que el sistema es adiabático cuando se da alguna de las siguientes condiciones:
es la diferencia de temperaturas media logarítmica, puede considerarse que el sistema es adiabático cuando se da alguna de las siguientes condiciones:
 es la diferencia de temperaturas media logarítmica, puede considerarse que el sistema es adiabático cuando se da alguna de las siguientes condiciones:
es la diferencia de temperaturas media logarítmica, puede considerarse que el sistema es adiabático cuando se da alguna de las siguientes condiciones:- La superficie externa del sistema está bien aislada térmicamente.
- La superficie externa del sistema es muy pequeña.
- La diferencia de temperaturas entre el flujo y el entorno del sistema es pequeña.
- El fluido pasa a través de la máquina tan rápido que apenas hay tiempo para que sea significativa la transferencia de calor por unidad de masa.
Máquina térmica en régimen permanente con variación de energía potencial despreciable[editar]
En una máquina térmica que funciona en régimen permanente en la cual se desprecie la variación de energía potencial, la expresión el primer principio de la termodinámica puede expresarse como
donde h0 es la entalpía de parada.
En los ciclos termodinámicos asociados a la turbina de vapor, la energía cinética específica puede considerarse despreciable frente a la entalpía, resultando
Rendimiento[editar]
Para el cálculo del rendimiento, se relaciona la energía obtenida, ya sea en forma de incremento de energía en el fluido o de energía mecánica suministrada por la máquina, entre la máxima energía que se podría obtener en las condiciones de contorno.
Rendimiento de una máquina térmica motora[editar]
- Rendimiento interno
El trabajo específico máximo que puede obtenerse en la expansión de un fluido está definido por la diferencia de entalpías entre el fluido a la entrada y las condiciones isoentrópicas a la presión de salida. En cambio el trabajo real es menor a éste debido al aumento de la entropía.2
- Rendimiento mecánico
El rendimiento mecánico es la relación entre potencia efectiva (( ), que es la potencia obtenida en el eje, y la potencia interna ((
), que es la potencia obtenida en el eje, y la potencia interna (( ), que es la variación por unidad de tiempo de la energía del fluido. La potencia efectiva resulta de restar a la potencia indicada menos la potencia de pérdidas mecánicas (
), que es la variación por unidad de tiempo de la energía del fluido. La potencia efectiva resulta de restar a la potencia indicada menos la potencia de pérdidas mecánicas ( ), que es disipada el rozamiento de elementos mecánicos (cojinetes, retenes, etc.) y en el accionamiento de elementos auxiliares (bomba de aceite, ventiladores, etc.)
), que es disipada el rozamiento de elementos mecánicos (cojinetes, retenes, etc.) y en el accionamiento de elementos auxiliares (bomba de aceite, ventiladores, etc.)
 ), que es la potencia obtenida en el eje, y la potencia interna ((
), que es la potencia obtenida en el eje, y la potencia interna (( ), que es la variación por unidad de tiempo de la energía del fluido. La potencia efectiva resulta de restar a la potencia indicada menos la potencia de pérdidas mecánicas (
), que es la variación por unidad de tiempo de la energía del fluido. La potencia efectiva resulta de restar a la potencia indicada menos la potencia de pérdidas mecánicas ( ), que es disipada el rozamiento de elementos mecánicos (cojinetes, retenes, etc.) y en el accionamiento de elementos auxiliares (bomba de aceite, ventiladores, etc.)
), que es disipada el rozamiento de elementos mecánicos (cojinetes, retenes, etc.) y en el accionamiento de elementos auxiliares (bomba de aceite, ventiladores, etc.)- Rendimiento isoentrópico
El rendimiento isoentrópico relaciona la potencia obtenida en el eje con potencia máxima del proceso isoentrópico en las mismas condiciones de contorno.
Rendimiento de una máquina térmica generadora[editar]
- Rendimiento interno
El trabajo específico mínimo para comprimir un fluido desde un estado térmico hasta una presión determinada es igual al salto entálpico del correspondiente proceso isoentrópico, de forma que un proceso real presentará mayor diferencia de entalpías del fluido entre la entrada y la salida.2
- Rendimiento mecánico
El rendimiento mecánico es la relación entre potencia efectiva (( ), que es la potencia obtenida en el eje, y la potencia interna ((
), que es la potencia obtenida en el eje, y la potencia interna (( ), que es la variación por unidad de tiempo de la energía del fluido. La potencia efectiva resulta de restar a la potencia indicada menos la potencia de pérdidas mecánicas (
), que es la variación por unidad de tiempo de la energía del fluido. La potencia efectiva resulta de restar a la potencia indicada menos la potencia de pérdidas mecánicas ( ), que es disipada el rozamiento de elementos mecánicos (cojinetes, retenes, etc.) y en el accionamiento de elementos auxiliares (bomba de aceite, ventiladores, etc.)
), que es disipada el rozamiento de elementos mecánicos (cojinetes, retenes, etc.) y en el accionamiento de elementos auxiliares (bomba de aceite, ventiladores, etc.)
 ), que es la potencia obtenida en el eje, y la potencia interna ((
), que es la potencia obtenida en el eje, y la potencia interna (( ), que es la variación por unidad de tiempo de la energía del fluido. La potencia efectiva resulta de restar a la potencia indicada menos la potencia de pérdidas mecánicas (
), que es la variación por unidad de tiempo de la energía del fluido. La potencia efectiva resulta de restar a la potencia indicada menos la potencia de pérdidas mecánicas ( ), que es disipada el rozamiento de elementos mecánicos (cojinetes, retenes, etc.) y en el accionamiento de elementos auxiliares (bomba de aceite, ventiladores, etc.)
), que es disipada el rozamiento de elementos mecánicos (cojinetes, retenes, etc.) y en el accionamiento de elementos auxiliares (bomba de aceite, ventiladores, etc.)- Rendimiento isoentrópico
El rendimiento isoentrópico relaciona potencia mínima del proceso isoentrópico en las mismas condiciones de contorno con la potencia suministrada en el eje.

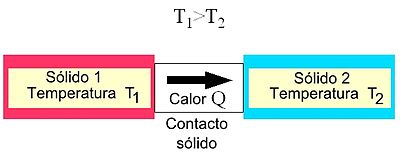

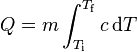

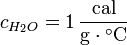

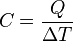
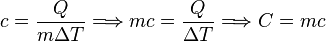




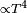 y la convección
y la convección 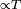 .
.

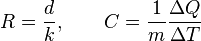
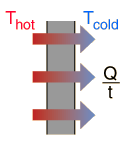
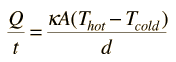
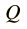

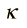
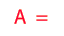
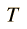
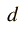
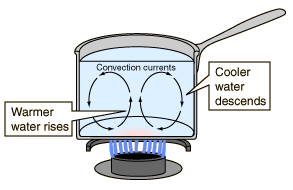






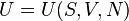



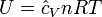
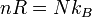 donde
donde







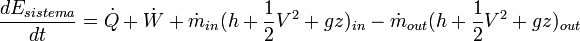

![\dot W = \dot m [(h + \frac{V^{2}}{2})_{out} - (h + \frac{V^{2}}{2})_{in}] = \dot m [ h_{0 out} - h_{0 in} ]](https://upload.wikimedia.org/math/0/4/b/04ba969e4508721476a6c9dd9a6e36c2.png)

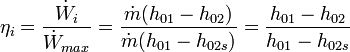
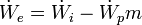



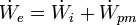


No hay comentarios.:
Publicar un comentario