- TERCER PARCIAL
- Equipo 1:
La Teoría Cuántica, una aproximación al universo probable
Es un conjunto de nuevas ideas que explican procesos incomprensibles para la física de los objetos
La Teoría Cuántica es uno de los pilares fundamentales de la Física actual. Recoge un conjunto de nuevas ideas introducidas a lo largo del primer tercio del siglo XX para dar explicación a procesos cuya comprensión se hallaba en conflicto con las concepciones físicas vigentes. Su marco de aplicación se limita, casi exclusivamente, a los niveles atómico, subatómico y nuclear, donde resulta totalmente imprescindible. Pero también lo es en otros ámbitos, como la electrónica, en la física de nuevos materiales, en la física de altas energías, en el diseño de instrumentación médica, en la criptografía y la computación cuánticas, y en la Cosmología teórica del Universo temprano. La Teoría Cuántica es una teoría netamente probabilista: describe la probabilidad de que un suceso dado acontezca en un momento determinado, sin especificar cuándo ocurrirá. A diferencia de lo que ocurre en la Física Clásica, en la Teoría Cuántica la probabilidad posee un valor objetivo esencial, y no se halla supeditada al estado de conocimiento del sujeto, sino que, en cierto modo, lo determina. Por Mario Toboso.

La Teoría Cuántica es uno de los pilares fundamentales de la Física actual. Se trata de una teoría que reúne un formalismo matemático y conceptual, y recoge un conjunto de nuevas ideas introducidas a lo largo del primer tercio del siglo XX, para dar explicación a procesos cuya comprensión se hallaba en conflicto con las concepciones físicas vigentes.
Las ideas que sustentan la Teoría Cuántica surgieron, pues, como alternativa al tratar de explicar el comportamiento de sistemas en los que el aparato conceptual de la Física Clásica se mostraba insuficiente. Es decir, una serie de observaciones empíricas cuya explicación no era abordable a través de los métodos existentes, propició la aparición de las nuevas ideas.
Hay que destacar el fuerte enfrentamiento que surgió entre las ideas de la Física Cuántica, y aquéllas válidas hasta entonces, digamos de la Física Clásica. Lo cual se agudiza aún más si se tiene en cuenta el notable éxito experimental que éstas habían mostrado a lo largo del siglo XIX, apoyándose básicamente en la mecánica de Newton y la teoría electromagnética de Maxwell (1865).
“Dos nubecillas”
Era tal el grado de satisfacción de la comunidad científica que algunos físicos, entre ellos uno de los más ilustres del siglo XIX, William Thompson (Lord Kelvin), llegó a afirmar:
Hoy día la Física forma, esencialmente, un conjunto perfectamente armonioso, ¡un conjunto prácticamente acabado! ... Aun quedan “dos nubecillas” que oscurecen el esplendor de este conjunto. La primera es el resultado negativo del experimento de Michelson-Morley. La segunda, las profundas discrepancias entre la experiencia y la Ley de Rayleigh-Jeans.
La disipación de la primera de esas “dos nubecillas” condujo a la creación de la Teoría Especial de la Relatividad por Einstein (1905), es decir, al hundimiento de los conceptos absolutos de espacio y tiempo, propios de la mecánica de Newton, y a la introducción del “relativismo” en la descripción física de la realidad. La segunda “nubecilla” descargó la tormenta de las primeras ideas cuánticas, debidas al físico alemán Max Planck (1900).
El origen de la Teoría Cuántica
¿Qué pretendía explicar, de manera tan poco afortunada, la Ley de Rayleigh-Jeans (1899)? Un fenómeno físico denominado radiación del cuerpo negro, es decir, el proceso que describe la interacción entre la materia y la radiación, el modo en que la materia intercambia energía, emitiéndola o absorbiéndola, con una fuente de radiación. Pero además de la Ley de Rayleigh-Jeans había otra ley, la Ley de Wien (1893), que pretendía también explicar el mismo fenómeno.
La Ley de Wien daba una explicación experimental correcta si la frecuencia de la radiación es alta, pero fallaba para frecuencias bajas. Por su parte, la Ley de Rayleigh-Jeans daba una explicación experimental correcta si la frecuencia de la radiación es baja, pero fallaba para frecuencias altas.
La frecuencia es una de las características que definen la radiación, y en general cualquier fenómeno en el que intervengan ondas. Puede interpretarse la frecuencia como el número de oscilaciones por unidad de tiempo. Toda la gama de posibles frecuencias para una radiación en la Naturaleza se hallan contenidas en el espectro electromagnético, el cual, según el valor de la frecuencia elegida determina un tipo u otro de radiación.
En 1900, Max Planck puso la primera piedra del edificio de la Teoría Cuántica. Postuló una ley (la Ley de Planck) que explicaba de manera unificada la radiación del cuerpo negro, a través de todo el espectro de frecuencias.
La hipótesis de Planck
¿Qué aportaba la ley de Planck que no se hallase ya implícito en las leyes de Wien y de Rayleigh-Jeans? Un ingrediente tan importante como novedoso. Tanto que es el responsable de la primera gran crisis provocada por la Teoría Cuántica sobre el marco conceptual de la Física Clásica. Ésta suponía que el intercambio de energía entre la radiación y la materia ocurría a través de un proceso continuo, es decir, una radiación de frecuencia f podía ceder cualquier cantidad de energía al ser absorbida por la materia.
Lo que postuló Planck al introducir su ley es que la única manera de obtener una fórmula experimentalmente correcta exigía la novedosa y atrevida suposición de que dicho intercambio de energía debía suceder de una manera discontinua, es decir, a través de la emisión y absorción de cantidades discretas de energía, que hoy denominamos “quantums” de radiación. La cantidad de energía E propia de un quantum de radiación de frecuencia f se obtiene mediante la relación de Planck: E = h x f, siendo h la constante universal de Planck = 6’62 x 10 (expo-34) (unidades de “acción”).
Puede entenderse la relación de Planck diciendo que cualquier radiación de frecuencia f se comporta como una corriente de partículas, los quantums, cada una de ellas transportando una energía E = h x f, que pueden ser emitidas o absorbidas por la materia.
La hipótesis de Planck otorga un carácter corpuscular, material, a un fenómeno tradicionalmente ondulatorio, como la radiación. Pero lo que será más importante, supone el paso de una concepción continuista de la Naturaleza a una discontinuista, que se pone especialmente de manifiesto en el estudio de la estructura de los átomos, en los que los electrones sólo pueden tener un conjunto discreto y discontinuo de valores de energía.
La hipótesis de Planck quedó confirmada experimentalmente, no sólo en el proceso de radiación del cuerpo negro, a raíz de cuya explicación surgió, sino también en las explicaciones del efecto fotoeléctrico, debida a Einstein (1905), y del efecto Compton, debida a Arthur Compton (1923).
Marco de aplicación de la Teoría Cuántica
El marco de aplicación de la Teoría Cuántica se limita, casi exclusivamente, a los niveles atómico, subatómico y nuclear, donde resulta totalmente imprescindible. Pero también lo es en otros ámbitos, como la electrónica (en el diseño de transistores, microprocesadores y todo tipo de componentes electrónicos), en la física de nuevos materiales, (semiconductores y superconductores), en la física de altas energías, en el diseño de instrumentación médica (láseres, tomógrafos, etc.), en la criptografía y la computación cuánticas, y en la Cosmología teórica del Universo temprano. De manera que la Teoría Cuántica se extiende con éxito a contextos muy diferentes, lo que refuerza su validez.
Pero, ¿por qué falla la teoría clásica en su intento de explicar los fenómenos del micromundo? ¿No se trata al fin y al cabo de una simple diferencia de escalas entre lo grande y lo pequeño, relativa al tamaño de los sistemas? La respuesta es negativa. Pensemos que no siempre resulta posible modelar un mismo sistema a diferentes escalas para estudiar sus propiedades.
Para ver que la variación de escalas es un proceso con ciertas limitaciones intrínsecas, supongamos que queremos realizar estudios hidrodinámicos relativos al movimiento de corrientes marinas. En determinadas condiciones, podríamos realizar un modelo a escala lo suficientemente completo, que no dejase fuera factores esenciales del fenómeno. A efectos prácticos una reducción de escala puede resultar lo suficientemente descriptiva.
Pero si reducimos la escala de manera reiterada pasaremos sucesivamente por situaciones que se corresponderán en menor medida con el caso real. Hasta llegar finalmente a la propia esencia de la materia sometida a estudio, la molécula de agua, que obviamente no admite un tratamiento hidrodinámico, y habremos de acudir a otro tipo de teoría, una teoría de tipo molecular. Es decir, en las sucesivas reducciones de escala se han ido perdiendo efectos y procesos generados por el aglutinamiento de las moléculas.
De manera similar, puede pensarse que una de las razones por las que la Física Clásica no es aplicable a los fenómenos atómicos, es que hemos reducido la escala hasta llegar a un ámbito de la realidad “demasiado esencial” y se hace necesario, al igual que en el ejemplo anterior, un cambio de teoría. Y de hecho, así sucede: la Teoría Cuántica estudia los aspectos últimos de la substancia, los constituyentes más esenciales de la materia (las denominadas “partículas elementales”) y la propia naturaleza de la radiación.
Las ideas que sustentan la Teoría Cuántica surgieron, pues, como alternativa al tratar de explicar el comportamiento de sistemas en los que el aparato conceptual de la Física Clásica se mostraba insuficiente. Es decir, una serie de observaciones empíricas cuya explicación no era abordable a través de los métodos existentes, propició la aparición de las nuevas ideas.
Hay que destacar el fuerte enfrentamiento que surgió entre las ideas de la Física Cuántica, y aquéllas válidas hasta entonces, digamos de la Física Clásica. Lo cual se agudiza aún más si se tiene en cuenta el notable éxito experimental que éstas habían mostrado a lo largo del siglo XIX, apoyándose básicamente en la mecánica de Newton y la teoría electromagnética de Maxwell (1865).
“Dos nubecillas”
Era tal el grado de satisfacción de la comunidad científica que algunos físicos, entre ellos uno de los más ilustres del siglo XIX, William Thompson (Lord Kelvin), llegó a afirmar:
Hoy día la Física forma, esencialmente, un conjunto perfectamente armonioso, ¡un conjunto prácticamente acabado! ... Aun quedan “dos nubecillas” que oscurecen el esplendor de este conjunto. La primera es el resultado negativo del experimento de Michelson-Morley. La segunda, las profundas discrepancias entre la experiencia y la Ley de Rayleigh-Jeans.
La disipación de la primera de esas “dos nubecillas” condujo a la creación de la Teoría Especial de la Relatividad por Einstein (1905), es decir, al hundimiento de los conceptos absolutos de espacio y tiempo, propios de la mecánica de Newton, y a la introducción del “relativismo” en la descripción física de la realidad. La segunda “nubecilla” descargó la tormenta de las primeras ideas cuánticas, debidas al físico alemán Max Planck (1900).
El origen de la Teoría Cuántica
¿Qué pretendía explicar, de manera tan poco afortunada, la Ley de Rayleigh-Jeans (1899)? Un fenómeno físico denominado radiación del cuerpo negro, es decir, el proceso que describe la interacción entre la materia y la radiación, el modo en que la materia intercambia energía, emitiéndola o absorbiéndola, con una fuente de radiación. Pero además de la Ley de Rayleigh-Jeans había otra ley, la Ley de Wien (1893), que pretendía también explicar el mismo fenómeno.
La Ley de Wien daba una explicación experimental correcta si la frecuencia de la radiación es alta, pero fallaba para frecuencias bajas. Por su parte, la Ley de Rayleigh-Jeans daba una explicación experimental correcta si la frecuencia de la radiación es baja, pero fallaba para frecuencias altas.
La frecuencia es una de las características que definen la radiación, y en general cualquier fenómeno en el que intervengan ondas. Puede interpretarse la frecuencia como el número de oscilaciones por unidad de tiempo. Toda la gama de posibles frecuencias para una radiación en la Naturaleza se hallan contenidas en el espectro electromagnético, el cual, según el valor de la frecuencia elegida determina un tipo u otro de radiación.
En 1900, Max Planck puso la primera piedra del edificio de la Teoría Cuántica. Postuló una ley (la Ley de Planck) que explicaba de manera unificada la radiación del cuerpo negro, a través de todo el espectro de frecuencias.
La hipótesis de Planck
¿Qué aportaba la ley de Planck que no se hallase ya implícito en las leyes de Wien y de Rayleigh-Jeans? Un ingrediente tan importante como novedoso. Tanto que es el responsable de la primera gran crisis provocada por la Teoría Cuántica sobre el marco conceptual de la Física Clásica. Ésta suponía que el intercambio de energía entre la radiación y la materia ocurría a través de un proceso continuo, es decir, una radiación de frecuencia f podía ceder cualquier cantidad de energía al ser absorbida por la materia.
Lo que postuló Planck al introducir su ley es que la única manera de obtener una fórmula experimentalmente correcta exigía la novedosa y atrevida suposición de que dicho intercambio de energía debía suceder de una manera discontinua, es decir, a través de la emisión y absorción de cantidades discretas de energía, que hoy denominamos “quantums” de radiación. La cantidad de energía E propia de un quantum de radiación de frecuencia f se obtiene mediante la relación de Planck: E = h x f, siendo h la constante universal de Planck = 6’62 x 10 (expo-34) (unidades de “acción”).
Puede entenderse la relación de Planck diciendo que cualquier radiación de frecuencia f se comporta como una corriente de partículas, los quantums, cada una de ellas transportando una energía E = h x f, que pueden ser emitidas o absorbidas por la materia.
La hipótesis de Planck otorga un carácter corpuscular, material, a un fenómeno tradicionalmente ondulatorio, como la radiación. Pero lo que será más importante, supone el paso de una concepción continuista de la Naturaleza a una discontinuista, que se pone especialmente de manifiesto en el estudio de la estructura de los átomos, en los que los electrones sólo pueden tener un conjunto discreto y discontinuo de valores de energía.
La hipótesis de Planck quedó confirmada experimentalmente, no sólo en el proceso de radiación del cuerpo negro, a raíz de cuya explicación surgió, sino también en las explicaciones del efecto fotoeléctrico, debida a Einstein (1905), y del efecto Compton, debida a Arthur Compton (1923).
Marco de aplicación de la Teoría Cuántica
El marco de aplicación de la Teoría Cuántica se limita, casi exclusivamente, a los niveles atómico, subatómico y nuclear, donde resulta totalmente imprescindible. Pero también lo es en otros ámbitos, como la electrónica (en el diseño de transistores, microprocesadores y todo tipo de componentes electrónicos), en la física de nuevos materiales, (semiconductores y superconductores), en la física de altas energías, en el diseño de instrumentación médica (láseres, tomógrafos, etc.), en la criptografía y la computación cuánticas, y en la Cosmología teórica del Universo temprano. De manera que la Teoría Cuántica se extiende con éxito a contextos muy diferentes, lo que refuerza su validez.
Pero, ¿por qué falla la teoría clásica en su intento de explicar los fenómenos del micromundo? ¿No se trata al fin y al cabo de una simple diferencia de escalas entre lo grande y lo pequeño, relativa al tamaño de los sistemas? La respuesta es negativa. Pensemos que no siempre resulta posible modelar un mismo sistema a diferentes escalas para estudiar sus propiedades.
Para ver que la variación de escalas es un proceso con ciertas limitaciones intrínsecas, supongamos que queremos realizar estudios hidrodinámicos relativos al movimiento de corrientes marinas. En determinadas condiciones, podríamos realizar un modelo a escala lo suficientemente completo, que no dejase fuera factores esenciales del fenómeno. A efectos prácticos una reducción de escala puede resultar lo suficientemente descriptiva.
Pero si reducimos la escala de manera reiterada pasaremos sucesivamente por situaciones que se corresponderán en menor medida con el caso real. Hasta llegar finalmente a la propia esencia de la materia sometida a estudio, la molécula de agua, que obviamente no admite un tratamiento hidrodinámico, y habremos de acudir a otro tipo de teoría, una teoría de tipo molecular. Es decir, en las sucesivas reducciones de escala se han ido perdiendo efectos y procesos generados por el aglutinamiento de las moléculas.
De manera similar, puede pensarse que una de las razones por las que la Física Clásica no es aplicable a los fenómenos atómicos, es que hemos reducido la escala hasta llegar a un ámbito de la realidad “demasiado esencial” y se hace necesario, al igual que en el ejemplo anterior, un cambio de teoría. Y de hecho, así sucede: la Teoría Cuántica estudia los aspectos últimos de la substancia, los constituyentes más esenciales de la materia (las denominadas “partículas elementales”) y la propia naturaleza de la radiación.

Albert Einstein
Cuándo entra en juego la Teoría Cuántica
Debemos asumir, pues, el carácter absoluto de la pequeñez de los sistemas a los que se aplica la Teoría Cuántica. Es decir, la cualidad “pequeño” o “cuántico” deja de ser relativa al tamaño del sistema, y adquiere un carácter absoluto. Y ¿qué nos indica si un sistema debe ser considerado “pequeño”, y estudiado por medio de la Teoría Cuántica? Hay una “regla”, un “patrón de medida” que se encarga de esto, pero no se trata de una regla calibrada en unidades de longitud, sino en unidades de otra magnitud física importante denominada “acción”.
La acción es una magnitud física, al igual que lo son la longitud, el tiempo, la velocidad, la energía, la temperatura, la potencia, la corriente eléctrica, la fuerza, etc., aunque menos conocida. Y al igual que la temperatura indica la cualidad de frío o caliente del sistema, y la velocidad su cualidad de reposo o movimiento, la acción indica la cualidad de pequeño (cuántico) o grande (clásico) del sistema. Como la energía, o una longitud, todo sistema posee también una acción que lo caracteriza.
Esta acción característica, A, se obtiene de la siguiente multiplicación de magnitudes: A = P x L, donde P representa la cantidad de movimiento característica del sistema (el producto de su masa por su velocidad) y L su “longitud” característica. La unidad de esa “regla” que mencionábamos, con la que medimos la acción de los sistemas, es la constante de Planck, h. Si el valor de la acción característica del sistema es del orden de la constante de Planck deberemos utilizar necesariamente la Teoría Cuántica a la hora de estudiarlo.
Al contrario, si h es muy pequeña comparada con la acción típica del sistema podremos estudiarlo a través de los métodos de la teoría clásica. Es decir: Si A es del orden de h debemos estudiar el sistema según la Teoría Cuántica. Si A es mucho mayor que h, podemos estudiarlo por medio de la Física Clásica.
Dos ejemplos: partículas y planetas
Veamos dos ejemplos de acción característica en dos sistemas diferentes, aunque análogos:
1. El electrón orbitando en torno al núcleo en el nivel más bajo de energía del átomo de hidrógeno.
Vamos a calcular el orden de magnitud del producto P x L. P representa el producto de la masa del electrón por su velocidad orbital, esto es P = 10 (exp-31) (masa) x 10 (exp 6) (velocidad) = 10 (exp-25) (cantidad de movimiento). El valor característico de L corresponde al radio de la órbita, esto es, L = 10 (expo-10) (longitud). Realizamos ahora el producto P x L para hallar la magnitud de la “acción” característica asociada a este proceso: A1 = Px L = 10 (expo-25) x 10 (expo-10) = 10 (expo-35) (acción).
2. El planeta Júpiter orbitando en torno al Sol (consideramos la órbita circular, para simplificar).
Para este segundo ejemplo, realizamos cálculos análogos a los anteriores. Primeramente la cantidad de movimiento P, multiplicando la masa de Júpiter por su velocidad orbital: P = 10 (expo 26) (masa) x 10 (expo 4) (velocidad) = 10 (expo 30) (cantidad de movimiento). Igualmente, la longitud característica será la distancia orbital media: L = 10 (expo 11) (longitud). La magnitud de la acción característica en este segundo caso será: A2 = 10 (expo 30) x 10 (expo 11) = 10 (expo 41) (acción).
Si comparamos estos dos resultados con el orden de magnitud de la constante de Planck tenemos:
h = 10 (expo-34)
A1 = 10 (expo -35)
A2 = 10 (expo 41)
Vemos que para el caso 1 (electrón orbitando en un átomo de hidrógeno) la proximidad en los órdenes de magnitud sugiere un tratamiento cuántico del sistema, que debe estimarse como “pequeño” en el sentido que indicábamos anteriormente, en términos de la constante de Planck, considerada como “patrón” de medida. Al contrario, entre el caso 2 (Júpiter en órbita en torno al Sol) y la constante de Planck hay una diferencia de 75 órdenes de magnitud, lo que indica que el sistema es manifiestamente “grande”, medido en unidades de h, y no requiere un estudio basado en la Teoría Cuántica.
La constante de Planck tiene un valor muy, muy pequeño. Veámoslo explícitamente:
h = 0’ 000000000000000000000000000000000662 (unidades de acción)
El primer dígito diferente de cero aparece en la trigésimo cuarta cifra decimal. La pequeñez extrema de h provoca que no resulte fácil descubrir los aspectos cuánticos de la realidad, que permanecieron ocultos a la Física hasta el siglo XX. Allá donde no sea necesaria la Teoría Cuántica, la teoría clásica ofrece descripciones suficientemente exactas de los procesos, como en el caso del movimiento de los planetas, según acabamos de ver.
Debemos asumir, pues, el carácter absoluto de la pequeñez de los sistemas a los que se aplica la Teoría Cuántica. Es decir, la cualidad “pequeño” o “cuántico” deja de ser relativa al tamaño del sistema, y adquiere un carácter absoluto. Y ¿qué nos indica si un sistema debe ser considerado “pequeño”, y estudiado por medio de la Teoría Cuántica? Hay una “regla”, un “patrón de medida” que se encarga de esto, pero no se trata de una regla calibrada en unidades de longitud, sino en unidades de otra magnitud física importante denominada “acción”.
La acción es una magnitud física, al igual que lo son la longitud, el tiempo, la velocidad, la energía, la temperatura, la potencia, la corriente eléctrica, la fuerza, etc., aunque menos conocida. Y al igual que la temperatura indica la cualidad de frío o caliente del sistema, y la velocidad su cualidad de reposo o movimiento, la acción indica la cualidad de pequeño (cuántico) o grande (clásico) del sistema. Como la energía, o una longitud, todo sistema posee también una acción que lo caracteriza.
Esta acción característica, A, se obtiene de la siguiente multiplicación de magnitudes: A = P x L, donde P representa la cantidad de movimiento característica del sistema (el producto de su masa por su velocidad) y L su “longitud” característica. La unidad de esa “regla” que mencionábamos, con la que medimos la acción de los sistemas, es la constante de Planck, h. Si el valor de la acción característica del sistema es del orden de la constante de Planck deberemos utilizar necesariamente la Teoría Cuántica a la hora de estudiarlo.
Al contrario, si h es muy pequeña comparada con la acción típica del sistema podremos estudiarlo a través de los métodos de la teoría clásica. Es decir: Si A es del orden de h debemos estudiar el sistema según la Teoría Cuántica. Si A es mucho mayor que h, podemos estudiarlo por medio de la Física Clásica.
Dos ejemplos: partículas y planetas
Veamos dos ejemplos de acción característica en dos sistemas diferentes, aunque análogos:
1. El electrón orbitando en torno al núcleo en el nivel más bajo de energía del átomo de hidrógeno.
Vamos a calcular el orden de magnitud del producto P x L. P representa el producto de la masa del electrón por su velocidad orbital, esto es P = 10 (exp-31) (masa) x 10 (exp 6) (velocidad) = 10 (exp-25) (cantidad de movimiento). El valor característico de L corresponde al radio de la órbita, esto es, L = 10 (expo-10) (longitud). Realizamos ahora el producto P x L para hallar la magnitud de la “acción” característica asociada a este proceso: A1 = Px L = 10 (expo-25) x 10 (expo-10) = 10 (expo-35) (acción).
2. El planeta Júpiter orbitando en torno al Sol (consideramos la órbita circular, para simplificar).
Para este segundo ejemplo, realizamos cálculos análogos a los anteriores. Primeramente la cantidad de movimiento P, multiplicando la masa de Júpiter por su velocidad orbital: P = 10 (expo 26) (masa) x 10 (expo 4) (velocidad) = 10 (expo 30) (cantidad de movimiento). Igualmente, la longitud característica será la distancia orbital media: L = 10 (expo 11) (longitud). La magnitud de la acción característica en este segundo caso será: A2 = 10 (expo 30) x 10 (expo 11) = 10 (expo 41) (acción).
Si comparamos estos dos resultados con el orden de magnitud de la constante de Planck tenemos:
h = 10 (expo-34)
A1 = 10 (expo -35)
A2 = 10 (expo 41)
Vemos que para el caso 1 (electrón orbitando en un átomo de hidrógeno) la proximidad en los órdenes de magnitud sugiere un tratamiento cuántico del sistema, que debe estimarse como “pequeño” en el sentido que indicábamos anteriormente, en términos de la constante de Planck, considerada como “patrón” de medida. Al contrario, entre el caso 2 (Júpiter en órbita en torno al Sol) y la constante de Planck hay una diferencia de 75 órdenes de magnitud, lo que indica que el sistema es manifiestamente “grande”, medido en unidades de h, y no requiere un estudio basado en la Teoría Cuántica.
La constante de Planck tiene un valor muy, muy pequeño. Veámoslo explícitamente:
h = 0’ 000000000000000000000000000000000662 (unidades de acción)
El primer dígito diferente de cero aparece en la trigésimo cuarta cifra decimal. La pequeñez extrema de h provoca que no resulte fácil descubrir los aspectos cuánticos de la realidad, que permanecieron ocultos a la Física hasta el siglo XX. Allá donde no sea necesaria la Teoría Cuántica, la teoría clásica ofrece descripciones suficientemente exactas de los procesos, como en el caso del movimiento de los planetas, según acabamos de ver.
Breve cronología de la Teoría Cuántica
1900. “Hipótesis cuántica de Planck” (Premio Nobel de Física, 1918). Carácter corpuscular de la radiación.
1905. Einstein (Premio Nobel de Física, 1921) explica el “efecto fotoeléctrico” aplicando la hipótesis de Planck.
1911. Experimentos de Rutherford, que establecen el modelo planetario átomo, con núcleo (protones) y órbitas externas (electrones).
1913. Modelo atómico de Niels Bohr (Premio Nobel de Física, 1922). Tiene en cuenta los resultados de Rutherford, pero añade además la hipótesis cuántica de Planck. Una característica esencial del modelo de Bohr es que los electrones pueden ocupar sólo un conjunto discontinuo de órbitas y niveles de energía.
1923. Arthrur Comptom (Premio Nobel de Física, 1927) presenta una nueva verificación de la hipótesis de Planck, a través de la explicación del efecto que lleva su nombre.
1924. Hipótesis de De Broglie (Premio Nobel de Física, 1929). Asocia a cada partícula material una onda, de manera complementaria a cómo la hipótesis de Planck dota de propiedades corpusculares a la radiación.
1925. Werner Heisenberg (Premio Nobel de Física, 1932) plantea un formalismo matemático que permite calcular las magnitudes experimentales asociadas a los estados cuánticos.
1926. Erwin Schrödinger (Premio Nobel de Física, 1933) plantea la ecuación ondulatoria cuyas soluciones son las ondas postuladas teóricamente por De Broglie en 1924.
1927. V Congreso Solvay de Física, dedicado al tema “Electrones y fotones”. En él se produce el debate entre Einstein y Bohr, como defensores de posturas antagónicas, sobre los problemas interpretativos que plantea la Teoría Cuántica.
1928. Experimentos de difracción de partículas (electrones) que confirman la hipótesis de de Broglie, referente a las propiedades ondulatorias asociadas a las partículas. El fenómeno de difracción es propio de las ondas.
1932. Aparición del trabajo de fundamentación de la Teoría Cuántica elaborado por el matemático Jon von Neumann.
1900. “Hipótesis cuántica de Planck” (Premio Nobel de Física, 1918). Carácter corpuscular de la radiación.
1905. Einstein (Premio Nobel de Física, 1921) explica el “efecto fotoeléctrico” aplicando la hipótesis de Planck.
1911. Experimentos de Rutherford, que establecen el modelo planetario átomo, con núcleo (protones) y órbitas externas (electrones).
1913. Modelo atómico de Niels Bohr (Premio Nobel de Física, 1922). Tiene en cuenta los resultados de Rutherford, pero añade además la hipótesis cuántica de Planck. Una característica esencial del modelo de Bohr es que los electrones pueden ocupar sólo un conjunto discontinuo de órbitas y niveles de energía.
1923. Arthrur Comptom (Premio Nobel de Física, 1927) presenta una nueva verificación de la hipótesis de Planck, a través de la explicación del efecto que lleva su nombre.
1924. Hipótesis de De Broglie (Premio Nobel de Física, 1929). Asocia a cada partícula material una onda, de manera complementaria a cómo la hipótesis de Planck dota de propiedades corpusculares a la radiación.
1925. Werner Heisenberg (Premio Nobel de Física, 1932) plantea un formalismo matemático que permite calcular las magnitudes experimentales asociadas a los estados cuánticos.
1926. Erwin Schrödinger (Premio Nobel de Física, 1933) plantea la ecuación ondulatoria cuyas soluciones son las ondas postuladas teóricamente por De Broglie en 1924.
1927. V Congreso Solvay de Física, dedicado al tema “Electrones y fotones”. En él se produce el debate entre Einstein y Bohr, como defensores de posturas antagónicas, sobre los problemas interpretativos que plantea la Teoría Cuántica.
1928. Experimentos de difracción de partículas (electrones) que confirman la hipótesis de de Broglie, referente a las propiedades ondulatorias asociadas a las partículas. El fenómeno de difracción es propio de las ondas.
1932. Aparición del trabajo de fundamentación de la Teoría Cuántica elaborado por el matemático Jon von Neumann.
Aspectos esencialmente novedosos de la Teoría Cuántica
Los aspectos esencialmente novedosos (no clásicos) que se derivan de la Teoría Cuántica son:
a) Carácter corpuscular de la radiación (Hipótesis de Planck).
b) Aspecto ondulatorio de las partículas (Hipótesis de Broglie).
c) Existencia de magnitudes físicas cuyo espectro de valores es discontinuo. Por ejemplo los niveles de energía del átomo de hidrógeno (Modelo atómico de Bohr).
Implicaciones de a): carácter corpuscular de la radiación.
Tradicionalmente se había venido considerando la radiación como un fenómeno ondulatorio. Pero la hipótesis de Planck la considera como una corriente de partículas, “quantums”. ¿Qué naturaleza tiene, entonces, la radiación: ondulatoria o corpuscular? Las dos. Manifiesta un carácter marcadamente “dual”. Se trata de aspectos que dentro del formalismo cuántico no se excluyen, y se integran en el concepto de “quantum”.
El quantum de radiación puede manifestar propiedades tanto corpusculares como ondulatorias, según el valor de la frecuencia de la radiación. Para valores altos de la frecuencia (en la región gamma del espectro) predomina el carácter corpuscular. En tanto que para frecuencias bajas (en la región del espectro que describe las ondas de radio) predomina el aspecto ondulatorio.
Implicaciones de b): carácter ondulatorio de las partículas.
Se comprobó en experimentos de difracción de electrones y neutrones. Lo que ponen de manifiesto estos experimentos es que una clase de onda acompaña el movimiento de las partículas como responsable del fenómeno de difracción. De manera que nuevamente tenemos un ejemplo de dualidad entre las propiedades corpusculares y ondulatorias, asociadas en este caso a las partículas.
Pero la aparición del fenómeno ondulatorio no se produce únicamente a nivel microscópico, también se manifiesta para objetos macroscópicos, aunque en este caso la onda asociada tiene una longitud de onda tan pequeña que en la práctica es inapreciable y resulta imposible la realización de un experimento de difracción que la ponga de manifiesto.
Implicaciones de c): existencia de magnitudes físicas discontinuas.
Pone de manifiesto el carácter intrínsecamente discontinuo de la Naturaleza, lo que se evidencia, como ejemplo más notable, en el espectro de energía de los átomos. A partir de la existencia de estas discontinuidades energéticas se explica la estabilidad de la materia.
Los aspectos esencialmente novedosos (no clásicos) que se derivan de la Teoría Cuántica son:
a) Carácter corpuscular de la radiación (Hipótesis de Planck).
b) Aspecto ondulatorio de las partículas (Hipótesis de Broglie).
c) Existencia de magnitudes físicas cuyo espectro de valores es discontinuo. Por ejemplo los niveles de energía del átomo de hidrógeno (Modelo atómico de Bohr).
Implicaciones de a): carácter corpuscular de la radiación.
Tradicionalmente se había venido considerando la radiación como un fenómeno ondulatorio. Pero la hipótesis de Planck la considera como una corriente de partículas, “quantums”. ¿Qué naturaleza tiene, entonces, la radiación: ondulatoria o corpuscular? Las dos. Manifiesta un carácter marcadamente “dual”. Se trata de aspectos que dentro del formalismo cuántico no se excluyen, y se integran en el concepto de “quantum”.
El quantum de radiación puede manifestar propiedades tanto corpusculares como ondulatorias, según el valor de la frecuencia de la radiación. Para valores altos de la frecuencia (en la región gamma del espectro) predomina el carácter corpuscular. En tanto que para frecuencias bajas (en la región del espectro que describe las ondas de radio) predomina el aspecto ondulatorio.
Implicaciones de b): carácter ondulatorio de las partículas.
Se comprobó en experimentos de difracción de electrones y neutrones. Lo que ponen de manifiesto estos experimentos es que una clase de onda acompaña el movimiento de las partículas como responsable del fenómeno de difracción. De manera que nuevamente tenemos un ejemplo de dualidad entre las propiedades corpusculares y ondulatorias, asociadas en este caso a las partículas.
Pero la aparición del fenómeno ondulatorio no se produce únicamente a nivel microscópico, también se manifiesta para objetos macroscópicos, aunque en este caso la onda asociada tiene una longitud de onda tan pequeña que en la práctica es inapreciable y resulta imposible la realización de un experimento de difracción que la ponga de manifiesto.
Implicaciones de c): existencia de magnitudes físicas discontinuas.
Pone de manifiesto el carácter intrínsecamente discontinuo de la Naturaleza, lo que se evidencia, como ejemplo más notable, en el espectro de energía de los átomos. A partir de la existencia de estas discontinuidades energéticas se explica la estabilidad de la materia.

Dios no juega a los dados...
Un ejemplo concreto
Analicemos para el caso del átomo de hidrógeno, según el modelo de Bohr, cómo se conjugan estos tres supuestos cuánticos anteriores, a), b) y c). El átomo de hidrógeno se entiende como un sistema estable formado por un electrón y un protón. El electrón puede hallarse en un conjunto infinito, pero discontinuo de niveles de energía [supuesto c)].
Para pasar de un nivel a otro, el electrón debe absorber o emitir un quantum discreto de radiación [supuesto a)] cuya energía sea igual a la diferencia de energía entre esos niveles. Los niveles posibles de energía de los electrones se representan matemáticamente por funciones ondulatorias [supuesto b)], denominadas “funciones de estado”, que caracterizan el estado físico del electrón en el nivel de energía correspondiente.
Para conocer el valor experimental de cualquier propiedad referente a la partícula debe “preguntarse” a su función de estado asociada. Es decir, dicha función constituye un tipo de representación del estado físico, tal que el estado del electrón en el n-ésimo nivel de energía es descrito por la n-ésima función de estado.
La función de onda
La descripción más general del estado del electrón del átomo de hidrógeno viene dada por la “superposición” de diferentes funciones de estado. Tal superposición es conocida como “función de onda”. La superposición de estados posibles es típica de la Teoría Cuántica, y no se presenta en las descripciones basadas en la Física Clásica.
En esta última, los estados posibles nunca se superponen, sino que se muestran directamente como propiedades reales atribuibles al estado del sistema. Al contrario, especificar el estado del sistema en la Teoría Cuántica implica tomar en consideración la superposición de todos sus estados posibles. Las funciones de onda no son ondas asociadas a la propagación de ningún campo físico (eléctrico, magnético, etc.), sino representaciones que permiten caracterizar matemáticamente los estados de las partículas a que se asocian.
El físico alemán Max Born ofreció la primera interpretación física de las funciones de onda, según la cual el cuadrado de su amplitud es una medida de la probabilidad de hallar la partícula asociada en un determinado punto del espacio en un cierto instante. Aquí se manifiesta un hecho que se repetirá a lo largo del desarrollo de la Teoría Cuántica, y es la aparición de la probabilidad como componente esencial de la gran mayoría de los análisis.
La probabilidad en la Teoría Cuántica
La Teoría Cuántica es una teoría netamente probabilista. Nos habla de la probabilidad de que un suceso dado acontezca en un momento determinado, no de cuándo ocurrirá ciertamente el suceso en cuestión. La importancia de la probabilidad dentro de su formalismo supuso el punto principal de conflicto entre Einstein y Bohr en el V Congreso Solvay de Física de 1927.
Einstein argumentaba que la fuerte presencia de la probabilidad en la Teoría Cuántica hacía de ella una teoría incompleta reemplazable por una hipotética teoría mejor, carente de predicciones probabilistas, y por lo tantodeterminista. Acuñó esta opinión en su ya famosa frase, “Dios no juega a los dados con el Universo”.
La postura de Einstein se basa en que el papel asignado a la probabilidad en la Teoría Cuántica es muy distinto del que desempeña en la Física Clásica. En ésta, la probabilidad se considera como una medida de la ignorancia del sujeto, por falta de información, sobre algunas propiedades del sistema sometido a estudio. Podríamos hablar, entonces, de un valor subjetivo de la probabilidad. Pero en la Teoría Cuántica la probabilidad posee un valor objetivo esencial, y no se halla supeditada al estado de conocimiento del sujeto, sino que, en cierto modo, lo determina.
En opinión de Einstein, habría que completar la Teoría Cuántica introduciendo en su formalismo un conjunto adicional de elementos de realidad (a los que se denominó “variables ocultas”), supuestamente obviados por la teoría, que al ser tenidos en cuenta aportarían la información faltante que convertiría sus predicciones probabilistas en predicciones deterministas.
Analicemos para el caso del átomo de hidrógeno, según el modelo de Bohr, cómo se conjugan estos tres supuestos cuánticos anteriores, a), b) y c). El átomo de hidrógeno se entiende como un sistema estable formado por un electrón y un protón. El electrón puede hallarse en un conjunto infinito, pero discontinuo de niveles de energía [supuesto c)].
Para pasar de un nivel a otro, el electrón debe absorber o emitir un quantum discreto de radiación [supuesto a)] cuya energía sea igual a la diferencia de energía entre esos niveles. Los niveles posibles de energía de los electrones se representan matemáticamente por funciones ondulatorias [supuesto b)], denominadas “funciones de estado”, que caracterizan el estado físico del electrón en el nivel de energía correspondiente.
Para conocer el valor experimental de cualquier propiedad referente a la partícula debe “preguntarse” a su función de estado asociada. Es decir, dicha función constituye un tipo de representación del estado físico, tal que el estado del electrón en el n-ésimo nivel de energía es descrito por la n-ésima función de estado.
La función de onda
La descripción más general del estado del electrón del átomo de hidrógeno viene dada por la “superposición” de diferentes funciones de estado. Tal superposición es conocida como “función de onda”. La superposición de estados posibles es típica de la Teoría Cuántica, y no se presenta en las descripciones basadas en la Física Clásica.
En esta última, los estados posibles nunca se superponen, sino que se muestran directamente como propiedades reales atribuibles al estado del sistema. Al contrario, especificar el estado del sistema en la Teoría Cuántica implica tomar en consideración la superposición de todos sus estados posibles. Las funciones de onda no son ondas asociadas a la propagación de ningún campo físico (eléctrico, magnético, etc.), sino representaciones que permiten caracterizar matemáticamente los estados de las partículas a que se asocian.
El físico alemán Max Born ofreció la primera interpretación física de las funciones de onda, según la cual el cuadrado de su amplitud es una medida de la probabilidad de hallar la partícula asociada en un determinado punto del espacio en un cierto instante. Aquí se manifiesta un hecho que se repetirá a lo largo del desarrollo de la Teoría Cuántica, y es la aparición de la probabilidad como componente esencial de la gran mayoría de los análisis.
La probabilidad en la Teoría Cuántica
La Teoría Cuántica es una teoría netamente probabilista. Nos habla de la probabilidad de que un suceso dado acontezca en un momento determinado, no de cuándo ocurrirá ciertamente el suceso en cuestión. La importancia de la probabilidad dentro de su formalismo supuso el punto principal de conflicto entre Einstein y Bohr en el V Congreso Solvay de Física de 1927.
Einstein argumentaba que la fuerte presencia de la probabilidad en la Teoría Cuántica hacía de ella una teoría incompleta reemplazable por una hipotética teoría mejor, carente de predicciones probabilistas, y por lo tantodeterminista. Acuñó esta opinión en su ya famosa frase, “Dios no juega a los dados con el Universo”.
La postura de Einstein se basa en que el papel asignado a la probabilidad en la Teoría Cuántica es muy distinto del que desempeña en la Física Clásica. En ésta, la probabilidad se considera como una medida de la ignorancia del sujeto, por falta de información, sobre algunas propiedades del sistema sometido a estudio. Podríamos hablar, entonces, de un valor subjetivo de la probabilidad. Pero en la Teoría Cuántica la probabilidad posee un valor objetivo esencial, y no se halla supeditada al estado de conocimiento del sujeto, sino que, en cierto modo, lo determina.
En opinión de Einstein, habría que completar la Teoría Cuántica introduciendo en su formalismo un conjunto adicional de elementos de realidad (a los que se denominó “variables ocultas”), supuestamente obviados por la teoría, que al ser tenidos en cuenta aportarían la información faltante que convertiría sus predicciones probabilistas en predicciones deterministas.
El modelo actual del átomo se basa en la mecánica cuántica ondulatoria, la cual está fundamentada en cuatro números cuánticos, mediante los cuales puede describirse un electrón en un átomo.
El desarrollo de está teoría durante la década de 1920 es el resultado de las contribuciones de destacados científicos entre ellos Einstein, Planck (1858-1947), de Broglie, Bohr (1885-1962), Schrödinger (1887-1961) y Heisenberg..
La siguiente figura muestra las modificaciones que ha sufrido el modelo del átomo desde Dalton hasta Schrödinger.
Teoría atómica
En química y física, la teoría atómica es una teoría científica sobre la naturaleza de la materia que sostiene que está compuesta de unidades discretas llamadas átomos. Empezó como concepto filosófico en la Antigua Grecia y logró amplia aceptación científica a principios del siglo XIX cuando descubrimientos en el campo de la química demostraron que la materia realmente se comportaba como si estuviese hecha de átomos.
La palabra átomo proviene del adjetivo en griego antiguo atomos, que significa "indivisible". Los químicos del siglo XIX empezaron a utilizar el término en relación con el número creciente de elementos químicos irreducibles.1 Mientras que alrededor del cambio al siglo XX, a través de varios experimentos con electromagnetismo y radiactividad, los físicos descubrieron que los "átomos indivisibles" eran de hecho un conglomerado de varias partículas subatómicas (principalmente, electrones, protones y neutrones), las que pueden existir separadas unas de otras. De hecho, en ciertos entornos extremos, como las estrellas de neutrones, la presión y la temperatura extremas impiden que los átomos puedan existir en absoluto. Ya que se descubrió que los átomos podían dividirse, los físicos inventaron el término "partículas elementales" para describir las partes "indivisibles", aunque no indestructibles, de un átomo. El campo de ciencia que estudia las partículas subatómicas es la física de partículas y es en este campo donde los físicos esperan descubrir la auténtica naturaleza fundamental de la materia.
Atomismo filosófico[editar]
La idea de que la materia está hecha de unidades discretas es una muy antigua y surge en muchas culturas antiguas como Grecia e India. No obstante, estas ideas estuvieron fundadas en el razonamiento filosófico y teológico más que en la evidencia y la experimentación. Como resultado, sus opiniones sobre cómo son los átomos y cómo se comportan eran muy incorrectas. Además no podían convencer a todo el mundo, así que el atomismo solo era una entre varias teorías rivales sobre la naturaleza de materia. No fue hasta el siglo XIX que los científicos abrazaron y refinaron la idea, ya que la floreciente ciencia de la química produjo descubrimientos que podían explicarse fácilmente utilizando el concepto del átomo.
Dalton[editar]
Cerca del fin del siglo XVIII, dos leyes sobre reacciones químicas emergieron sin referirse a la idea de una teoría atómica. La primera era la ley de conservación de masa, formulada por Antoine Lavoisier en 1789, la cual declara que la masa total permanece constante tras una reacción química (es decir, los reactantes tienen la misma masa que los productos).2 La segunda era la ley de proporciones definitivas. Probada originalmente por el farmacéutico francés Joseph Louis Proust en 1799, esta ley declara que si se descompone un compuesto en sus elementos constituyentes, entonces las masas de los elementos siempre tendrán las mismas proporciones, sin importar la cantidad o fuente de la sustancia original.3
John Dalton estudió y expandió este trabajo previo y desarrolló la ley de las proporciones múltiples: si dos elementos pueden combinarse para formar una cantidad de compuestos posibles, entonces las proporciones de las masas del segundo elemento que se combinan con una masa fija del primer elemento serán proporciones de números enteros pequeños. Por ejemplo: Proust había estudiado óxidos de estaño y descubrió que sus masas eran 88.1% estaño y 11.9% oxígeno o 78.7% estaño y 21.3% oxígeno (estos eran óxido de estaño (II) y dióxido de estaño respectivamente). Dalton notó en estos porcentajes que 100 g de estaño se combinará con 13,5 g o 27 g de oxígeno; 13,5 y 27 forman una proporción de 1:2. Dalton descubrió que una teoría atómica de la materia podría explicar elegantemente este patrón común en la química. En el caso de los óxidos de estaño de Proust, un átomo de estaño se combinará con uno o dos átomos de oxígeno.4
Dalton también creía que la teoría atómica podía explicar por qué el agua absorbió gases diferentes en proporciones diferentes. Por ejemplo, descubrió que el agua absorbiódióxido de carbono mucho mejor que el nitrógeno.5 Dalton hipotetizó que este se debió a las diferencias en masa y complejidad de las partículas de los gases respectivos. Ciertamente, las moléculas de dióxido de carbono (CO2) son más pesadas y grandes que las moléculas de nitrógeno (N2).
Propuso que cada elemento químico está compuesto de átomos de un solo tipo solo y aunque estos no pueden ser alterados o destruidos por medios químicos, pueden combinarse para formar estructuras más complejas (compuestos químicos). Esto marca la primera teoría verdaderamente científica del átomo, ya que Dalton logró sus conclusiones por experimentación y examen de los resultados de forma empírica.
En 1803 presentó su primera lista de pesos atómicos relativos para un número de sustancias. Este artículo se publicó en 1805, pero en él Dalton no analizó exactamente cómo obtuvo esas cifras.5 El método fue revelado en 1807 por su conocido Thomas Thomson, en la tercera edición del libro de Thomson, Un Sistema de Química. Finalmente, Dalton publicó una explicación completa en su propio texto,Un Nuevo Sistema de Filosofía Química (1808 y 1810).
Dalton estimó los pesos atómicos según las proporciones de masa en que se combinan, tomando al átomo de hidrógeno la unidad. Sin embargo, Dalton no concibió que con algunos elementos los átomos existen en moléculas, por ejemplo el oxígeno puro existe como O2. También creyó erróneamente que el compuesto más sencillo entre dos elementos cualesquiera es siempre un átomo de cada uno (así que pensó que el agua era HO, no H2O).6 Esto, sumado a la crudeza de su equipamiento, malogró sus resultados. Por ejemplo, en 1803 creía que los átomos de oxígeno eran 5,5 veces más pesados que los átomos de hidrógeno, porque en el agua midió 5,5 gramos de oxígeno por cada gramo de hidrógeno y creía que la fórmula para el agua era HO. Con datos mejores, en 1806 concluyó que el peso atómico del oxígeno de hecho debía ser 7 en vez de 5,5, y mantuvo este peso por el resto de su vida. Otros en estos tiempos ya habían concluido que el átomo de oxígeno tiene que pesar 8 átomos de hidrógeno si uno supone la fórmula de Dalton para la molécula de agua (HO), o 16 si uno supone la fórmula moderna (H2O).7
Avogadro[editar]
El defecto en la teoría de Dalton fue corregida en principio en 1811 por Amedeo Avogadro. Avogadro había propuesto que volúmenes iguales de cualesquier dos gases, en presión y temperatura iguales, contienen números iguales de moléculas (en otras palabras, la masa de las partículas de un gas no afecta el volumen que ocupa).8 La ley de Avogadro le permitió deducir la naturaleza diatómica de numerosos gases al estudiar los volúmenes en los que reaccionan. Por ejemplo: ya que dos litros de hidrógeno reaccionarán con un único litro de oxígeno para producir dos litros de vapor de agua (en temperatura y presión constantes), significa que una sola molécula de oxígeno se divide en dos para formar dos partículas de agua. De este modo Avogadro fue capaz de ofrecer estimaciones más precisas de la masa atómica del oxígeno y varios otros elementos e hizo una distinción clara entre moléculas y átomos.
Movimiento browniano[editar]
En 1827, el botánico británico Robert Brown observó que las partículas de polvo dentro de los granos de polen que flotan en el agua constantemente vibran sin razón aparente. En 1905, Albert Einstein teorizó que este movimiento browniano era causado por el continuo golpeteo de las moléculas de agua y desarrolló un modelo matemático para describirlo.9 En 1908 el físico francés Jean Perrin la validó experimentalmente, lo que proveyó de validación adicional a la teoría particular (y por extensión a la teoría atómica).
Descubrimiento de las partículas subatómicas[editar]
Hasta 1897, se creía que los átomos eran la división más pequeña de la materia, cuando J.J Thomson descubrió el electrón mediante su experimento con el tubo de rayos catódicos.10 El tubo de rayos catódicos que usó Thomson era un recipiente cerrado de vidrio, en el cual los dos electrodos estaban separados por un vacío. Cuando se aplica una diferencia de tensión a los electrodos, se generan rayos catódicos, que crean un resplandor fosforescente cuando chocan con el extremo opuesto del tubo de cristal. Mediante la experimentación, Thomson descubrió que los rayos se desviaban al aplicar un campo eléctrico (además de desviarse con los campos magnéticos, cosa que ya se sabía). Afirmó que estos rayos, más que ondas, estaban compuestos por partículas cargadas negativamente a las que llamó "corpúsculos" (más tarde, otros científicos las rebautizarían como electrones).
Thomson creía que los corpúsculos surgían de los átomos del electrodo. De esta forma, estipuló que los átomos eran divisibles, y que los corpúsculos eran sus componentes. Para explicar la carga neutra del átomo, propuso que los corpúsculos se distribuían en estructuras anilladas dentro de una nube positiva uniforme; este era el modelo atómico de Thomson o "modelo del plum cake".11
Ya que se vio que los átomos eran realmente divisibles, los físicos inventaron más tarde el término "partículas elementales" para designar a las partículas indivisibles.
Descubrimiento del núcleo[editar]
El modelo atómico de Thomson fue refutado en 1909 por uno de sus estudiantes, Ernest Rutherford, quien descubrió que la mayor parte de la masa y de la carga positiva de un átomo estaba concentrada en una fracción muy pequeña de su volumen, que suponía que estaba en el mismo centro.
En su experimento, Hans Geiger y Ernest Marsden bombardearon partículas alfa a través de una fina lámina de oro (que chocarían con unapantalla fluorescente que habían colocado rodeando la lámina).12 Dada la mínima como masa de los electrones, la elevada masa y momento de las partículas alfa y la distribución uniforme de la carga positiva del modelo de Thomson, estos científicos esperaban que todas las partículas alfa atravesasen la lámina de oro sin desviarse, o por el contrario, que fuesen absorbidas. Para su asombro, una pequeña fracción de las partículas alfa sufrió una fuerte desviación. Esto indujo a Rutherford a proponer el modelo planetario del átomo, en el que los electrones orbitaban en el espacio alrededor de un gran núcleo compacto, a semejanza de los planetas y el Sol.13
Descubrimiento de los isótopos[editar]
En 1913, Thomson canalizó una corriente de iones de neón a través de campos magnéticos y eléctricos, hasta chocar con una placa fotográfica que había colocado al otro lado. Observó dos zonas incandescentes en la placa, que revelaban dos trayectorias de desviación diferentes. Thomson concluyó que esto era porque algunos de los iones de neón tenían diferentes masas; así fue como descubrió la existencia de los isótopos.14
Descubrimiento del neutrón[editar]
Véase también: Neutrón#Historia
En 1918, Rutherford logró partir el núcleo del átomo al bombardear gas nitrógeno con partículas alfa, y observó que el gas emitía núcleos de hidrógeno. Rutherford concluyó que los núcleos de hidrógeno procedían de los núcleos de los mismos átomos de nitrógeno.15 Más tarde descubrió que la carga positiva de cualquier átomo equivalía siempre a un número entero de núcleos de hidrógeno. Esto, junto con el hecho de que el hidrógeno —el elemento más ligero— tenía una masa atómica de 1, le llevó a afirmar que los núcleos de hidrógeno eran partículas singulares, constituyentes básicos de todos los núcleos atómicos: se había descubierto el protón. Un experimento posterior de Rutherford mostró que la masa nuclear de la mayoría de los átomos superaba a la de los protones que tenía. Por tanto, postuló la existencia de partículas sin carga, hasta entonces desconocidas más tarde llamadas neutrones, de donde provendría este exceso de masa.
En 1928, Walther Bothe observó que el berilio emitía una radiación eléctricamente neutra cuando se le bombardeaba con partículas alfa. En 1932, James Chadwick expuso diversos elementos a esta radiación y dedujo que esta estaba compuesta por partículas eléctricamente neutras con una masa similar la de un protón.16 Chadwick llamó a estas partículas "neutrones".
Modelos cuánticos del átomo[editar]
El modelo planetario del átomo tenía sus defectos. En primer lugar, según la fórmula de Larmor del electromagnetismo clásico, una carga eléctrica en aceleración emite ondas electromagnéticas, y una carga en órbita iría perdiendo energía y describiría una espiral hasta acabar cayendo en el núcleo. Otro fenómeno que el modelo no explicaba era por qué los átomos excitados solo emiten luz con ciertos espectros discretos.
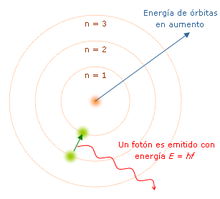
La teoría cuántica revolucionó la física de comienzos del siglo XX, cuando Max Planck y Albert Einstein postularon que se emite o absorbe una leve cantidad de energía en cantidades fijas llamadas cuantos. En 1913, Niels Bohr incorporó esta idea a su modelo atómico, en el que los electrones solo podrían orbitar alrededor del núcleo en órbitas circulares determinadas, con una energía y unmomento angular fijos, y siendo proporcionales las distancias del núcleo a los respectivos niveles de energía.17 Según este modelo, los átomos no podrían describir espirales hacia el núcleo porque no podrían perder energía de manera continua; en cambio, solo podrían realizar "saltos cuánticos" instantáneos entre los niveles fijos de energía.18 Cuando esto ocurre, el átomo absorbe o emite luz a una frecuencia proporcional a la diferencia de energía (y de ahí la absorción y emisión de luz en los espectros discretos).18 Arnold Sommerfeld amplió el átomo de Bohr en 1916 para incluir órbitas elípticas, utilizando una cuantificación de momento generalizado.
El modelo de Bohr-Sommerfeld ad hoc era muy difícil de utilizar, pero a cambio hacía increíbles predicciones de acuerdo con ciertas propiedades espectrales. Sin embargo, era incapaz de explicar los átomos multielectrónicos, predecir la tasa de transición o describir las estructuras finas e hiperfinas.
En 1924, Louis de Broglie propuso que todos los objetos —particularmente las partículas subatómicas, como los electrones— podían tener propiedades de ondas. Erwin Schrödinger, fascinado por esta idea, investigó si el movimiento de un electrón en un átomo se podría explicar mejor como onda que como partícula. La ecuación de Schrödinger, publicada en 1926,19 describe al electrón como una función de onda en lugar de como una partícula, y predijo muchos de los fenómenos espectrales que el modelo de Bohr no podía explicar. Aunque este concepto era matemáticamente correcto, era difícil de visualizar, y tuvo sus detractores.20 Uno de sus críticos,Max Born, dijo que la función de onda de Schrödinger no describía el electrón, pero sí a muchos de sus posibles estados, y de esta forma se podría usar para calcular la probabilidad de encontrar un electrón en cualquier posición dada alrededor del núcleo.21
En 1927, Werner Heisenberg indicó que, puesto que una función de onda está determinada por el tiempo y la posición, es imposible obtener simultáneamente valores precisos tanto para la posición como para el momento de la partícula para cualquier punto dado en el tiempo.22 Este principio fue conocido como principio de incertidumbre de Heisenberg.
Este nuevo enfoque invalidaba por completo el modelo de Bohr, con sus órbitas circulares claramente definidas. El modelo moderno del átomo describe las posiciones de los electrones en un átomo en términos de probabilidades. Un electrón se puede encontrar potencialmente a cualquier distancia del núcleo, pero —dependiendo de su nivel de energía— tiende a estar con más frecuencia en ciertas regiones alrededor del núcleo que en otras; estas zonas son conocidas como orbitales atómicos.
Importancia[editar]
La importancia de esta teoría no puede ser exagerada. Se ha dicho (por ejemplo el premio NobelRichard Feynman) que la teoría atómica es la teoría más importante en la historia de la ciencia. Esto se debe a las implicaciones que ha tenido, tanto para la ciencia básica como por las aplicaciones que se han derivado de ella.
Toda la química y bioquímica modernas se basan en la teoría de que la materia está compuesta de átomos de diferentes elementos, que no pueden transmutarse por métodos químicos. Por su parte, la química ha permitido el desarrollo de la industria farmacéutica, petroquímica, de abonos, el desarrollo de nuevos materiales, incluidos lossemiconductores, y otros avances.
CONTENIDO
- HISTORIA DE LA TEORIA ATOMICA 4
- TEORIA ATOMICA 5
- TEORIA ATOMICA DE DALTON 6
- MODELOS ATOMICOS 8
El Modelo de Thomson 8
El Modelo de Rutherford 8
Modelo Atómico de Niels Bohr 13
Modelo Cuántico (Actual) 15
- BIBLIOGRAFIA 20
HISTORIA DE LA TEORIA ATOMICA
Cinco siglos antes de Cristo, los filósofos griegos se preguntaban si la materia podía ser dividida indefinidamente o si llegaría a un punto, que tales partículas, fueran indivisibles. Es así, como Demócrito formula la teoría de que la materia se compone de partículas indivisibles, a las que llamó átomos (del griego átomos, indivisible).
En 1803 el químico inglés John Dalton propone una nueva teoría sobre la constitución de la materia. Según Dalton toda la materia se podía dividir en dos grandes grupos: los elementos y los compuestos. Los elementos estarían constituidos por unidades fundamentales, que en honor a Demócrito, Dalton denominó átomos. Los compuestos se constituirían de moléculas, cuya estructura viene dada por la unión de átomos en proporciones definidas y constantes. La teoría de Dalton seguía considerando el hecho de que los átomos eran partículas indivisibles.
Hacia finales del siglo XIX, se descubrió que los átomos no son indivisibles, pues se componen de varios tipos de partículas elementales. La primera en ser descubierta fue el electrón en el año 1897 por el investigador Sir Joseph Thomson, quién recibió el Premio Nobel de Física en 1906. Posteriormente, Hantaro Nagaoka (1865-1950) durante sus trabajos realizados en Tokio, propone su teoría según la cual los electrones girarían en órbitas alrededor de un cuerpo central cargado positivamente, al igual que los planetas alrededor del Sol. Hoy día sabemos que la carga positiva del átomo se concentra en un denso núcleo muy pequeño, en cuyo alrededor giran los electrones.
El núcleo del átomo se descubre gracias a los trabajos realizados en la Universidad de Manchester, bajo la dirección de Ernest Rutherford entre los años 1909 a 1911. El experimento utilizado consistía en dirigir un haz de partículas de cierta energía contra una plancha metálica delgada, de las probabilidades que tal barrera desviara la trayectoria de las partículas, se dedujo la distribución de la carga eléctrica al interior de los átomos.
TEORIA ATOMICA
La descripción básica de la constitución atómica, reconoce la existencia de partículas con carga eléctrica negativa, llamados electrones, los cuales giran en diversas órbitas (niveles de energía) alrededor de un núcleo central con carga eléctrica positiva. El átomo en su conjunto y sin la presencia de perturbaciones externas es eléctricamente neutro.
El núcleo lo componen los protones con carga eléctrica positiva, y los neutrones que no poseen carga eléctrica.
El tamaño de los núcleos atómicos para los diversos elementos están comprendidos entre una cien milésima y una diez milésima del tamaño del átomo.
La cantidad de protones y de electrones presentes en cada átomo es la misma. Esta cantidad recibe el nombre de número atómico, y se designa por la letra "Z". A la cantidad total de protones más neutrones presentes en un núcleo atómico se le llama número másico y se designa por la letra "A".
Si designamos por "X" a un elemento químico cualquiera, su número atómico y másico se representa por la siguiente simbología:
ZXA
Por ejemplo, para el Hidrogeno tenemos: 1H1.
Si bien, todas las características anteriores de la constitución atómica, hoy en día son bastante conocidas y aceptadas, a través de la historia han surgido diversos módelos que han intentado dar respuesta sobre la estructura del átomo.
TEORÍA ATÓMICA DE DALTON 

Aproximadamente por el año 1808, define a los átomos como la unidad constitutiva de los elementos (retomando las ideas de los atomistas griegos). Las ideas básicas de su teoría, publicadas en 1808 y 1810 pueden resumirse en los siguientes puntos:
- La materia está formada por partículas muy pequeñas para ser vistas, llamadas átomos.
- Los átomos de un elemento son idénticos en todas sus propiedades, incluyendo el peso.
- Diferentes elementos están formados por diferentes átomos.
- Los compuestos químicos se forman de la combinación de átomos de dos o más elementos, en un átomo compuesto; o lo que es lo mismo, un compuesto químico es el resultado de la combinación de átomos de dos o más elementos en una proporción numérica simple.
- Los átomos son indivisibles y conservan sus características durante las reacciones químicas.
- En cualquier reacción química, los átomos se combinan en proporciones numéricas simples.
- La separación de átomos y la unión se realiza en las reacciones químicas. En estas reacciones, ningún átomo se crea o destruye y ningún átomo de un elemento se convierte en un átomo de otro elemento.
A pesar de que la teoría de Dalton era errónea en varios aspectos, significó un avance cualitativo importante en el camino de la comprensión de la estructura de la materia. Por supuesto que la aceptación del modelo de Dalton no fue inmediata, muchos científicos se resistieron durante muchos años a reconocer la existencia de dichas partículas.
Además de sus postulados Dalton empleó diferentes símbolos para representar los átomos y los átomos compuestos, las moléculas.
Sin embargo, Dalton no elabora ninguna hipótesis acerca de la estructura de los átomos y habría que esperar casi un siglo para que alguien expusiera una teoría acerca de la misma.
Otras Leyes que concordaban con la teoría de Dalton:
- Ley de la Conservación de la Masa: La Materia no se crea ni se destruye, sólo se transforma.
- Ley de las Proporciones Definidas: Un Compuesto Puro siempre contiene los mismos elementos combinados en las mismas proporciones en masa.
- Ley de las Proporciones Múltiples: Cuando dos elementos A y B forman más de un compuesto, las cantidades de A que se combinan en estos compuestos, con una cantidad fija de B, están en relación de números pequeños enteros.
MODELOS ATOMICOS
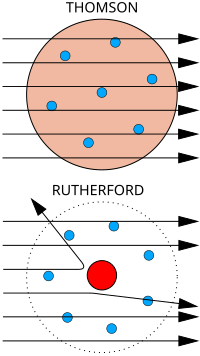
El Modelo de Thomson.
Thomson sugiere un modelo atómico que tomaba en cuenta la existencia del electrón, descubierto por él en 1897. Su modelo era estático, pues suponía que los electrones estaban en reposo dentro del átomo y que el conjunto era eléctricamente neutro. Con este modelo se podían explicar una gran cantidad de fenómenos atómicos conocidos hasta la fecha. Posteriormente, el descubrimiento de nuevas partículas y los experimentos llevado a cabo por Rutherford demostraron la inexactitud de tales ideas.
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas (Figura N° 01).
Figura N° 01
Una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella. El número de cargas negativas era el adecuado para neutralizar la carga positiva.
En el caso de que el átomo perdiera un electrón, la estructura quedaría positiva; y si ganaba, la carga final sería negativa. De esta forma, explicaba la formación de iones; pero dejó sin explicación la existencia de las otras radiaciones.
El Modelo de Ernest Rutherford.
Basado en los resultados de su trabajo, que demostró la existencia del núcleo atómico, Rutherford sostiene que casi la totalidad de la masa del átomo se concentra en un núcleo central muy diminuto de carga eléctrica positiva. Los electrones giran alrededor del núcleo describiendo órbitas circulares. Estos poseen una masa muy ínfima y tienen carga eléctrica negativa. La carga eléctrica del núcleo y de los electrones se neutralizan entre sí, provocando que el átomo sea eléctricamente neutro.
El modelo de Rutherford tuvo que ser abandonado, pues el movimiento de los electrones suponía una pérdida continua de energía, por lo tanto, el electrón terminaría describiendo órbitas en espiral, precipitándose finalmente hacia el núcleo. Sin embargo, este modelo sirvió de base para el modelo propuesto por su discípulo Neils Bohr, marcando el inicio del estudio del núcleo atómico, por lo que a Rutherford se le conoce como el padre de la era nuclear.
Ernest Rutherford estudió los componentes de la radiación que ocurre espontáneamente en la Naturaleza. A continuación se presenta una tabla resumiendo las características de estos componentes:
Fue Erwin Schodinger, quien ideó el modelo atómico actual, llamado "Ecuación de Onda", una fórmula matemática que considera los aspectos anteriores. La solución de esta ecuación, es la función de onda (PSI), y es una medida de la probabilidad de encontrar al electrón en el espacio. En este modelo, el área donde hay mayor probabilidad de encontrar al electrón se denomina orbital.
El valor de la función de onda 
asociada con una partícula en movimiento esta relacionada con la probabilidad de encontrar a la partícula en el punto (x,y,z) en el instante de tiempo t.
asociada con una partícula en movimiento esta relacionada con la probabilidad de encontrar a la partícula en el punto (x,y,z) en el instante de tiempo t.
En general una onda puede tomar valores positivos y negativos. Por ejemplo la onda:
En general una onda puede representarse por medio de una cantidad compleja:
Piense por ejemplo en el campo eléctrico de una onda electromagnética. Una probabilidad negativa, o compleja, es algo sin sentido. Esto significa que la función de onda no es algo observable. Sin embargo el módulo (o cuadrado) de la función de onda siempre es real y positivo. Por esto, a 
se le conoce como la densidad de probabilidad.
se le conoce como la densidad de probabilidad.
Ahora sí podemos dar una interpretación física:

Nubes de probabilidad electrónicas: 

En el caso más general de una función de onda compleja
el cuadrado esta dado por:
La función de onda depende de los valores de tres (03) variables que reciben la denominación de números cuánticos. Cada conjunto de números cuánticos, definen una función específica para un electrón.
Números Cuánticos:
Son cuatro (04) los números encargados de definir la función de onda (PSI) asociada a cada electrón de un átomo: el principal, secundario, magnético y de Spin. Los tres (03) primeros resultan de la ecuación de onda; y el último, de las observaciones realizadas de los campos magnéticos generados por el mismo átomo.
Número cuántico principal
Es un criterio positivo, representado por la letra "n", indica los niveles energéticos principales. Se encuentra relacionado con el tamaño. En la medida que su valor aumenta, el nivel ocupa un volumen mayor y puede contener más electrones, y su contenido energético es superior. Sus valores pueden ser desde 1 hasta infinito.
Número cuántico secundario
Representado por la letra "I", nos indica la forma que pueden tener el espacio donde se encuentra el electrón. El valor que se le asigna depende del número principal; va desde cero (0) hasta n-1.
Se ha conseguido que para dos (02)
Equipo 2:
Teoría de la relatividad
La teoría de la relatividad incluye tanto a la teoría de la relatividad especial como la de relatividad general, formuladas por Albert Einstein a principios del siglo XX, que pretendían resolver la incompatibilidad existente entre la mecánica newtoniana y elelectromagnetismo.
La teoría de la relatividad especial, publicada en 1905, trata de la física del movimiento de los cuerpos en ausencia de fuerzasgravitatorias, en el que se hacían compatibles las ecuaciones de Maxwell del electromagnetismo con una reformulación de las leyes del movimiento.
La teoría de la relatividad general, publicada en 1915, es una teoría de la gravedad que reemplaza a la gravedad newtoniana, aunque coincide numéricamente con ella para campos gravitatorios débiles y "pequeñas" velocidades. La teoría general se reduce a la teoría especial en ausencia de campos gravitatorios.
Conceptos principales[editar]
El supuesto básico de la teoría de la relatividad es que la localización de los sucesos físicos, tanto en el tiempo como en el espacio, son relativos al estado de movimiento delobservador: así, la longitud de un objeto en movimiento o el instante en que algo sucede, a diferencia de lo que sucede en mecánica newtoniana, no son invariantes absolutos, y diferentes observadores en movimiento relativo entre sí diferirán respecto a ellos (las longitudes y los intervalos temporales, en relatividad son relativos y no absolutos).
Relatividad especial[editar]
La teoría de la relatividad especial, también llamada teoría de la relatividad restringida, fue publicada por Albert Einstein en 1905 y describe la física del movimiento en el marco de un espacio-tiempo plano. Esta teoría describe correctamente el movimiento de los cuerpos incluso a grandes velocidades y sus interacciones electromagnéticas, se usa básicamente para estudiar sistemas de referencia inerciales (no es aplicable para problemas astrofísicos donde el campo gravitatorio desempeña un papel importante).
Estos conceptos fueron presentados anteriormente por Poincaré y Lorentz, que son considerados como precursores de la teoría. Si bien la teoría resolvía un buen número de problemas del electromagnetismo y daba una explicación del experimento de Michelson-Morley, no proporciona una descripción relativista adecuada del campo gravitatorio.
Tras la publicación del artículo de Einstein, la nueva teoría de la relatividad especial fue aceptada en unos pocos años por la práctica totalidad de los físicos y los matemáticos. De hecho, Poincaré o Lorentz habían estado muy cerca de llegar al mismo resultado que Einstein. La forma geométrica definitiva de la teoría se debe a Hermann Minkowski, antiguo profesor de Einstein en la Politécnica de Zürich; acuñó el término "espacio-tiempo" (Raumzeit) y le dio la forma matemática adecuada.nota 1 El espacio-tiempo de Minkowski es una variedad tetradimensional en la que se entrelazaban de una manera insoluble las tres dimensiones espaciales y el tiempo. En este espacio-tiempo de Minkowski, el movimiento de una partícula se representa mediante su línea de universo (Weltlinie), una curva cuyos puntos vienen determinados por cuatro variables distintas: las tres dimensiones espaciales (,,) y el tiempo (). El nuevo esquema de Minkowski obligó a reinterpretar los conceptos de la métrica existentes hasta entonces. El concepto tridimensional de punto fue sustituido por el de suceso. La magnitud de distancia se reemplaza por la magnitud de intervalo.
Relatividad general[editar]
La relatividad general fue publicada por Einstein en 1915, presentada como conferencia en la Academia de Ciencias Prusiana el 25 de noviembre. La teoría generaliza el principio de relatividad de Einstein para un observador arbitrario. Esto implica que las ecuaciones de la teoría deben tener una forma de covariancia más general que la covariancia de Lorentz usada en la teoría de la relatividad especial. Además de esto, la teoría de la relatividad general propone que la propia geometría del espacio-tiempo se ve afectada por la presencia de materia, de lo cual resulta una teoría relativista del campo gravitatorio. De hecho la teoría de la relatividad general predice que el espacio-tiempo no será plano en presencia de materia y que la curvatura del espacio-tiempo será percibida como un campo gravitatorio.
Debe notarse que el matemático alemán David Hilbert escribió e hizo públicas las ecuaciones de la covarianza antes que Einstein. Ello resultó en no pocas acusaciones de plagio contra Einstein, pero probablemente sea más, porque es una teoría (o perspectiva) geométrica. La misma postula que la presencia de masa o energía «curva» al espacio-tiempo, y esta curvatura afecta la trayectoria de los cuerpos móviles e incluso la trayectoria de la luz.
Einstein expresó el propósito de la teoría de la relatividad general para aplicar plenamente el programa de Ernst Mach de la relativización de todos los efectos de inercia, incluso añadiendo la llamada constante cosmológica a sus ecuaciones de campo4 para este propósito. Este punto de contacto real de la influencia de Ernst Mach fue claramente identificado en 1918, cuando Einstein distingue lo que él bautizó como el principio de Mach (los efectos inerciales se derivan de la interacción de los cuerpos) del principio de la relatividad general, que se interpreta ahora como el principio de covarianza general.5
Formalismo de la teoría de la relatividad[editar]
Partículas[editar]
En la teoría de la relatividad una partícula puntual queda representada por un par , donde es una curva diferenciable, llamada línea de universo de la partícula, y m es un escalar que representa la masa en reposo. El vector tangente a esta curva es un vector temporal llamado cuadrivelocidad, el producto de este vector por la masa en reposo de la partícula es precisamente el cuadrimomento. Este cuadrimomento es un vector de cuatro componentes, tres de estas componentes se denominan espaciales y representan el análogo relativista del momento lineal de la mecánica clásica, la otra componente denominada componente temporal representa la generalización relativista de la energía cinética. Además, dada una curva arbitraria en el espacio-tiempo, puede definirse a lo largo de ella el llamado intervalo relativista, que se obtiene a partir del tensor métrico. El intervalo relativista medido a lo largo de la trayectoria de una partícula es proporcional al intervalo de tiempo propio o intervalo de tiempo percibido por dicha partícula.
Campos[editar]
Cuando se consideran campos o distribuciones continuas de masa, se necesita algún tipo de generalización para la noción de partícula. Un campo físico posee momentum y energía distribuidos en el espacio-tiempo, el concepto de cuadrimomento se generaliza mediante el llamado tensor de energía-impulso que representa la distribución en el espacio-tiempo tanto de energía como de momento lineal. A su vez un campo dependiendo de su naturaleza puede representarse por un escalar, un vector o un tensor. Por ejemplo el campo electromagnético se representa por un tensor de segundo orden totalmente antisimétrico o 2-forma. Si se conoce la variación de un campo o una distribución de materia, en el espacio y en el tiempo entonces existen procedimientos para construir su tensor de energía-impulso.
Magnitudes físicas[editar]
En relatividad, estas magnitudes físicas son representadas por vectores 4-dimensionales o bien por objetos matemáticos llamados tensores, que generalizan los vectores, definidos sobre un espacio de cuatro dimensiones. Matemáticamente estos 4-vectores y 4-tensores son elementos definidos del espacio vectorial tangente al espacio-tiempo (y los tensores se definen y se construyen a partir del fibrado tangente o cotangente de la variedad que representa el espacio-tiempo).
| Espacio tridimensional euclídeo | Espacio-tiempo de Minkowski |
|---|---|
| Punto | Suceso |
| Longitud | Intervalo |
| Velocidad | Cuadrivelocidad |
| Momentum | Cuadrimomentum |
Igualmente además de cuadrivectores, se definen cuadritensores (tensores ordinarios definidos sobre el fibrado tangente del espacio-tiempo concebido como variedad lorentziana). La curvatura del espacio-tiempo se representa por un 4-tensor (tensor de cuarto orden), mientras que la energía y el momento de un medio continuo o el campo electromagnético se representan mediante 2-tensores (simétrico el tensor energía-impulso, antisimétrico el de campo electromagnético). Los cuadrivectores son de hecho 1-tensores, en esta terminología. En este contexto se dice que una magnitud es un invariante relativista si tiene el mismo valor para todos los observadores, obviamente todos los invariantes relativistas son escalares (0-tensores), frecuentemente formados por la contracción de magnitudes tensoriales.
El intervalo relativista[editar]
El intervalo relativista puede definirse en cualquier espacio-tiempo, sea este plano como en la relatividad especial, o curvo como en relatividad general. Sin embargo, por simplicidad, discutiremos inicialmente el concepto de intervalo para el caso de un espacio-tiempo plano. El tensor métrico del espacio-tiempo plano de Minkowski se designa con la letra , y en coordenadas galileanas o inerciales toma la siguiente forma:nota 4
El intervalo, la distancia tetradimensional, se representa mediante la expresión , que se calcula del siguiente modo:
Los intervalos pueden ser clasificados en tres categorías: Intervalos espaciales (cuando es negativo), temporales (si es positivo) y nulos (cuando ). Como el lector habrá podido comprobar, los intervalos nulos son aquellos que corresponden a partículas que se mueven a la velocidad de la luz, como los fotones: La distancia recorrida por el fotón es igual a su velocidad (c) multiplicada por el tiempo y por lo tanto el intervalo se hace nulo.
Los intervalos nulos pueden ser representados en forma de cono de luz, popularizados por el celebérrimo libro de Stephen Hawking, Historia del Tiempo. Sea un observador situado en el origen, el futuro absoluto (los sucesos que serán percibidos por el individuo) se despliega en la parte superior del eje de ordenadas, el pasado absoluto (los sucesos que ya han sido percibidos por el individuo) en la parte inferior, y el presente percibido por el observador en el punto 0. Los sucesos que están fuera del cono de luz no nos afectan, y por lo tanto se dice de ellos que están situados en zonas del espacio-tiempo que no tienen relación de causalidad con la nuestra.
Imaginemos, por un momento, que en la galaxia Andrómeda, situada a 2,5 millones de años luz de nosotros, sucedió un cataclismo cósmico hace 100 000 años. Dado que, primero: la luz de Andrómeda tarda dos millones de años en llegar hasta nosotros y segundo: nada puede viajar a una velocidad superior a la de los fotones, es evidente, que no tenemos manera de enterarnos de lo que sucedió en dicha Galaxia hace tan solo 100 000 años. Se dice por lo tanto que el intervalo existente entre dicha hipotética catástrofe cósmica y nosotros, observadores del presente, es un intervalo espacial (), y por lo tanto, no puede afectar a los individuos que en el presente viven en la Tierra: Es decir, no existe relación de causalidad entre ese evento y nosotros.
- Análisis
El único problema con esta hipótesis, es que al entrar en un agujero negro, se anula el espacio tiempo, y como ya sabemos, algo que contenga algún volumen o masa, debe tener como mínimo un espacio donde ubicarse, el tiempo en ese caso, no tiene mayor importancia, pero el espacio juega un rol muy importante en la ubicación de volúmenes, por lo que esto resulta muy improbable, pero no imposible para la tecnología.
Podemos escoger otro episodio histórico todavía más ilustrativo: El de la estrella de Belén, tal y como fue interpretada porJohannes Kepler. Este astrónomo alemán consideraba que dicha estrella se identificaba con una supernova que tuvo lugar el año 5 a. C., cuya luz fue observada por los astrónomos chinos contemporáneos, y que vino precedida en los años anteriores por varias conjunciones planetarias en la constelación de Piscis. Esa supernova probablemente estalló hace miles de años atrás, pero su luz no llegó a la tierra hasta el año 5 a. C. De ahí que el intervalo existente entre dicho evento y las observaciones de los astrónomos egipcios y megalíticos (que tuvieron lugar varios siglos antes de Cristo) sea un intervalo espacial, pues la radiación de la supernova nunca pudo llegarles. Por el contrario, la explosión de la supernova por un lado, y las observaciones realizadas por los tres magos en Babilonia y por los astrónomos chinos en el año 5 a. C. por el otro, están unidas entre sí por un intervalo temporal, ya que la luz sí pudo alcanzar a dichos observadores.
El tiempo propio y el intervalo se relacionan mediante la siguiente equivalencia: , es decir, el intervalo es igual al tiempo local multiplicado por la velocidad de la luz. Una de las características tanto del tiempo local como del intervalo es su invarianza ante las transformaciones de coordenadas. Sea cual sea nuestro punto de referencia, sea cual sea nuestra velocidad, el intervalo entre un determinado evento y nosotros permanece invariante.
Esta invarianza se expresa a través de la llamada geometría hiperbólica: La ecuación del intervalo tiene la estructura de una hipérbola sobre cuatro dimensiones, cuyotérmino independiente coincide con el valor del cuadrado del intervalo (), que como se acaba de decir en el párrafo anterior, es constante. Las asíntotas de la hipérbola vendrían a coincidir con el cono de luz.
Cuadrivelocidad, aceleración y cuadrimomentum[editar]
En el espacio-tiempo de Minkowski, las propiedades cinemáticas de las partículas se representan fundamentalmente por tres magnitudes: La cuadrivelocidad (o tetravelocidad) , la cuadriaceleración y el cuadrimomentum (o tetramomentum).
La cuadrivelocidad es un cuadrivector tangente a la línea de universo de la partícula, relacionada con la velocidad coordenada de un cuerpo medida por un observador en reposo cualquiera, esta velocidad coordenada se define con la expresión newtoniana , donde son el tiempo coordenado y las coordenadas espaciales medidas por el observador, para el cual la velocidad newtoniana ampliada vendría dada por . Sin embargo, esta medida newtoniana de la velocidad no resulta útil en teoría de la relatividad, porque las velocidades newtonianas medidas por diferentes observadores no son fácilmente relacionables por no ser magnitudes covariantes. Así en relatividad se introduce una modificación en las expresiones que dan cuenta de la velocidad, introduciendo un invariante relativista. Este invariante es precisamente el tiempo propio de la partícula que es fácilmente relacionable con el tiempo coordenado de diferentes observadores. Usando la relación entre tiempo propio y tiempo coordenado: se define la cuadrivelocidad [propia] multiplicando por las de la velocidad coordenada: .
La velocidad coordenada de un cuerpo con masa depende caprichosamente del sistema de referencia que escojamos, mientras que la cuadrivelocidad propia es una magnitud que se transforma de acuerdo con el principio de covariancia y tiene un valor siempre constante equivalente al intervalo dividido entre el tiempo propio (), o lo que es lo mismo, a la velocidad de la luz c. Para partículas sin masa, como los fotones, el procedimiento anterior no se puede aplicar, y la cuadrivelocidad puede definirse simplemente como vector tangente a la trayectoria seguida por los mismos.
La cuadriaceleración puede ser definida como la derivada temporal de la cuadrivelocidad (). Su magnitud es igual a cero en los sistemas inerciales, cuyas líneas del mundo son geodésicas, rectas en el espacio-tiempo llano de Minkowski. Por el contrario, las líneas del mundo curvadas corresponden a partículas con aceleración diferente de cero, a sistemas no inerciales.
Junto con los principios de invarianza del intervalo y la cuadrivelocidad, juega un papel fundamental la ley de conservación del cuadrimomentum. Es aplicable aquí la definición newtoniana del momentum () como la masa (en este caso conservada, ) multiplicada por la velocidad (en este caso, la cuadrivelocidad), y por lo tanto sus componentes son los siguientes: , teniendo en cuenta que . La cantidad de momentum conservado es definida como la raíz cuadrada de la norma del vector de cuadrimomentum. El momentum conservado, al igual que el intervalo y la cuadrivelocidad propia, permanece invariante ante las transformaciones de coordenadas, aunque también aquí hay que distinguir entre los cuerpos con masa y los fotones. En los primeros, la magnitud del cuadriomentum es igual a la masa multiplicada por la velocidad de la luz (). Por el contrario, el cuadrimomentum conservado de los fotones es igual a la magnitud de su momentum tridimensional ().
Como tanto la velocidad de la luz como el cuadrimomentum son magnitudes conservadas, también lo es su producto, al que se le da el nombre de energía conservada (), que en los cuerpos con masa equivale a la masa multiplicada por la velocidad de la luz al cuadrado (, la famosa fórmula de Einstein) y en losfotones al momentum multiplicado por la velocidad de la luz ()
Componentes
Magnitud del cuadrimomentum
Magnitud en cuerpos con masa
Magnitud en fotones (masa = 0)
Magnitud en fotones (masa = 0)
Energía
Energía en cuerpos con masa (cuerpos en reposo, p=0)
Energía en fotones (masa en reposo = 0)
Energía en fotones (masa en reposo = 0)
La aparición de la Relatividad Especial puso fin a la secular disputa que mantenían en el seno de la mecánica clásica las escuelas de los mecanicistas y los energetistas. Los primeros sostenían, siguiendo a Descartes y Huygens, que la magnitud conservada en todo movimiento venía constituida por el momentum total del sistema, mientras que los energetistas -que tomaban por base los estudios de Leibniz- consideraban que la magnitud conservada venía conformada por la suma de dos cantidades: La fuerza viva, equivalente a la mitad de la masa multiplicada por la velocidad al cuadrado () a la que hoy denominaríamos "energía cinética", y la fuerza muerta, equivalente a la altura por la constante g (), que correspondería a la "energía potencial". Fue el físico alemán Hermann von Helmholtz el que primero dio a la fuerzas leibnizianas la denominación genérica de energía y el que formuló la Ley de conservación de la energía, que no se restringe a la mecánica, que se extiende también a otras disciplinas físicas como la termodinámica.
La mecánica newtoniana dio la razón a ambos postulados, afirmando que tanto el momentum como la energía son magnitudes conservadas en todo movimiento sometido a fuerzas conservativas. Sin embargo, la Relatividad Especial dio un paso más allá, por cuanto a partir de los trabajos de Einstein y Minkowski el momentum y la energía dejaron de ser considerados como entidades independientes y se les pasó a considerar como dos aspectos, dos facetas de una única magnitud conservada: el cuadrimomentum.
- En primer lugar la masa no es una magnitud absoluta, sino que su medición deriva en resultados diferentes dependiendo de la velocidad relativa del observador. De ahí que la densidad de masa no puede servir de parámetro de interacción gravitatoria entre dos cuerpos.
- En segundo lugar, si el concepto de espacio es relativo, también lo es la noción de densidad. Es evidente que la contracción del espacio producida por el incremento de la velocidad de un observador, impide la existencia de densidades que permanezcan invariables ante las transformaciones de Lorentz.
Por todo ello, resulta necesario prescindir del término , situado en el lado derecho de la fórmula de Poisson y sustituirlo por un objeto geométrico-matemático que permanezca invariante ante las transformaciones de Lorentz: Dicho objeto fue definido por Einstein en sus ecuaciones de universo y recibe el nombre de tensor de energía-momentum (). Sus coeficientes describen la cantidad de tetramomentum que atraviesa una hipersuperficie , normal al vector unitario . De este modo, el tensor de energía momentum puede expresarse mediante la siguiente ecuación:
O lo que es lo mismo: El componente del tetramomentum es igual a la integral de hipersuperficie del tensor de tensión-energía. En un fluido ideal, del que están ausentes tanto la viscosidad como la conducción de calor, los componentes del tetramomentum se calculan de la siguiente forma:
donde es la densidad de masa-energía (masa por unidad de volumen tridimensional), es la presión hidrostática, es la cuadrivelocidad del fluido, y es lamatriz inversa del tensor métrico de la variedad.
Además, si los componentes del tensor se miden por un observador en reposo relativo respecto al fluido, entonces, el tensor métrico viene constituido simplemente por la métrica de Minkowski:
Puesto que además la tetravelocidad del fluido respecto al observador en reposo es:
como consecuencia de ello, los coeficientes del tensor de tensión-energía son los siguientes:
Donde es la densidad de masa, y son los componentes tridimensionales de la presión hidrostática. Como vemos, el campo gravitatorio tiene dos fuentes diferentes: La masa y el momentum del fluido en cuestión. Los efectos gravitatorios originados por la masa se denominan efectos gravitoeléctricos, mientras que aquellos que se deben al momentum reciben el nombre de efectos gravitomagnéticos. Los primeros tienen una intensidad superior a los segundos, que solo se manifiestan en aquellos casos en los que las partículas del fluido se mueven con una velocidad cercana a la de la luz (se habla entonces de fluidos relativistas): Es el caso de los chorros (jets) que emanan del centro de la galaxia y que se propulsan en las dos direcciones marcadas por el eje de rotación de este cuerpo cósmico; de la materia que se precipita hacia un agujero negro; y del fluido estelar que se dirige hacia el centro de la estrella cuando esta entra en colapso. En este último caso, durante las fases finales del proceso de contracción de la estrella, la presión hidrostática puede llegar a ser tan fuerte como para llegar a acelerar el colapso, en lugar de ralentizarlo.
Podemos, a partir del tensor de tensión-energía, calcular cuánta masa contiene un determinado volumen del fluido: Retomando la definición de este tensor expuesta unas líneas más arriba, se puede definir al coeficiente como la cantidad de momentum (esto es, la masa) que atraviesa la hipersuperficie . En el espacio-tiempo de Minkowski, la hipersuperficie es aquella región que se define por las tres bases vectoriales normales al vector : es, por tanto, un volumen tridimensional, definido por los vectores base (eje x), (eje y), y (eje z). Podemos por tanto escribir:
Del mismo modo, es posible deducir matemáticamente a partir del tensor de tensión-energía la definición newtoniana de presión, introduciendo en la mentada ecuación cualquier par de índices que sean diferentes de cero:
La hipersuperficie es aquella región del espacio-tiempo definida por los tres vectores unitarios normales a (se trata de los dos vectores espaciales, y , correspondientes a los ejes y y z; y del vector temporal —o , como se prefiera—). Esta definición nos permite descomponer la integral de hipersuperficie en una integral temporal (cuyo integrando viene definido por ) y otra de superficie (esta vez bidimensional, ):
Finalmente, derivamos parcialmente ambos miembros de la ecuación respecto al tiempo, y teniendo en cuenta que la fuerza no es más que la tasa de incremento temporal del momentum obtenemos el resultado siguiente:
Que contiene la definición newtoniana de la presión como fuerza ejercida por unidad de superficie.
El tensor electromagnético (Fab)[editar]
Las ecuaciones deducidas por el físico escocés James Clerk Maxwell demostraron que electricidad y magnetismo no son más que dos manifestaciones de un mismo fenómeno físico: el campo electromagnético. Ahora bien, para describir las propiedades de este campo los físicos de finales del siglo XIX debían utilizar dos vectores diferentes, los correspondientes los campos eléctrico y magnético.
Fue la llegada de la Relatividad Especial la que permitió describir las propiedades del electromagnetismo con un solo objeto geométrico, el vector cuadripotencial, cuyo componente temporal se correspondía con el potencial eléctrico, mientras que sus componentes espaciales eran los mismos que los del potencial magnético.
De este modo, el campo eléctrico puede ser entendido como la suma del gradiente del potencial eléctrico más la derivada temporal del potencial magnético:
y el campo magnético, como el rotacional del potencial magnético:
Las propiedades del campo electromagnético pueden también expresarse utilizando un tensor de segundo orden denominado tensor de Faraday y que se obtiene diferenciando exteriormente al vector cuadripotencial
La fuerza de Lorentz puede deducirse a partir de la siguiente expresión:
Donde q es la carga y la cuadrivelocidad de la partícula.
Relatividad, Predecibilidad y Caos
Teoría de la relatividad
La teoría de la relatividad está compuesta a grandes rasgos por dos grandes teorías (la de la relatividad especial y la de la relatividad general) formuladas por Albert Einstein a principios del siglo XX, que pretendían resolver la incompatibilidad existente entre la mecánica y el electromagnetismo.
La primera teoría, publicada en 1905, trata de la física del movimiento de los cuerpos en ausencia de fuerzas gravitatorias, en el que se hacían compatibles las ecuaciones de Maxwell del electromagnetismo con una reformulación de las leyes del movimiento. La segunda, de 1915, es una teoría de la gravedad que reemplaza a la gravedad newtoniana pero coincide numéricamente con ella en campos gravitatorios débiles. La teoría general se reduce a la teoría especial en ausencia de campos gravitatorios.
Relatividad especial (relatividad restringida)
Publicada por Albert Einstein en 1905, describe la física del movimiento en el marco de un espacio-tiempo plano, describe correctamente el movimiento de los cuerpos incluso a grandes velocidades y sus interacciones electromagnéticas y se usa básicamente para estudiar sistemas de referencia inerciales.
Relatividad General
Publicada por Albert Einstein en 1915 y 1916.
Predecibilidad
Predicción tiene por etimología el latín pre+dicere, esto es, “decir antes”. No se trata sólo de “decir antes”, sino de “decirlo bien”, o sea, acertar; también, hacerlo con un plazo suficiente para poder tomar las medidas que se crean oportunas, y además tener una idea de hasta cuándo es posible predecir el futuro con cierto éxito.
Cuando se efectúa una predicción, se está estimando un valor futuro de alguna variable que se considere representativa de una cierta situación.
También se pueden hacer predicciones espaciales, como la ubicación, movilidad e intensidad local de fenómenos extremos, caso por ejemplo de los huracanes y tormentas tropicales
Normalmente ambos tipos de predicción están ligados y se realizan a la vez, como lo prueban los productos que ofrecen las s grandes agencias e institutos de Meteorología y Climatología.
Pueden construirse de modos muy diversos, de algunos de los cuales nos ocuparemos en este trabajo, y su bondad se mide -como es natural- por el porcentaje de aciertos en situaciones del pasado predichas con igual técnica. Las bases de registros disponibles hoy día permiten realizar experimentos de predecibilidad con datos pasados y simular situaciones ya conocidas mediante diversas técnicas, estudiando y comparando los resultados.
CAOS
Teoría del caos es la denominación popular de la rama de las matemáticas, la física y otras ciencias que trata ciertos tipos de sistemas dinámicos muy sensibles a las variaciones en las condiciones iniciales. Pequeñas variaciones en dichas condiciones iniciales pueden implicar grandes diferencias en el comportamiento futuro; complicando la predicción a largo plazo. Esto sucede aunque estos sistemas son en rigor determinismos es decir; su comportamiento puede ser completamente determinado conociendo sus condiciones iniciales.
Los sistemas dinámicos se pueden clasificar básicamente en:
Estables, Inestables, Caóticos.
Un sistema estable tiende a lo largo del tiempo a un punto, u órbita, según su dimensión (a tractor o sumidero). Un sistema inestable se escapa de los atractores. Y un sistema caótico manifiesta los dos comportamientos. Por un lado, existe un a tractor por el que el sistema se ve atraído, pero a la vez, hay "fuerzas" que lo alejan de éste. De esa manera, el sistema permanece confinado en una zona de su espacio de estados, pero sin tender a un a tractor fijo.
A tractores extraños
La mayoría de los tipos de movimientos mencionados en la teoría anterior suceden alrededor de a tractores muy simples, tales como puntos y curvas circulares llamadas ciclos límite. En cambio, el movimiento caótico está ligado a lo que se conoce como a tractores extraños, que pueden llegar a tener una enorme complejidad como, por ejemplo, el modelo tridimensional del sistema climático de Lorenz, que lleva al famoso a tractor de Lorenz conocidos, no sólo porque fue uno de los primeros, sino también porque es uno de los más complejos y peculiares, pues desenvuelve una forma muy peculiar más bien parecida a las alas de una mariposa.
EFECTO MARIPOSA La idea de la que parte la Teoría del Caos es simple: en determinados sistemas naturales, pequeños cambios en las condiciones iniciales conducen a enormes discrepancias en los resultados. Este principio suele llamarse efecto mariposa debido a que, en meteorología, la naturaleza no lineal de la atmósfera ha hecho afirmar que es posible que el aleteo de una mariposa en determinado lugar y momento, pueda ser la causa de un terrible huracán varios meses más tarde en la otra punta del globo.
Equipo 3:
Núcleo atómico
El núcleo atómico es la parte central de un átomo, tiene carga positiva, y concentra más del 99,9% de la masa total del átomo.
Está formado por protones y neutrones (denominados nucleones) que se mantienen unidos por medio de la interacción nuclear fuerte, la cual permite que el núcleo sea estable, a pesar de que los protones se repelen entre sí (como los polos iguales de dos imanes). La cantidad de protones en el núcleo (número atómico), determina el elemento químico al que pertenece. Los núcleos atómicos no necesariamente tienen el mismo número de neutrones, ya que átomos de un mismo elemento pueden tener masas diferentes, es decir son isótopos del elemento.
La existencia del núcleo atómico fue deducida del experimento de Rutherford, donde se bombardeó una lámina fina de oro con partículas alfa, que son núcleos atómicos de helio emitidos por rocas radiactivas. La mayoría de esas partículas traspasaban la lámina, pero algunas rebotaban, lo cual demostró la existencia de un minúsculo núcleo atómico.
Historia[editar]
El descubrimiento de los electrones fue la primera indicación de la estructura interna de los átomos. A comienzos del siglo XX el modelo aceptado del átomo era el de JJ Thomson "pudín de pasas" modelo en el cual el átomo era una gran bola de carga positiva con los pequeños electrones cargados negativamente incrustado dentro de la misma. Por aquel entonces, los físicos habían descubierto también tres tipos de radiaciones procedentes de los átomos : alfa, beta y radiación gamma. Los experimentos de 1911realizados por Lise Meitner y Otto Hahn, y por James Chadwick en 1914 mostraron que el espectro de decaimiento beta es continuo y no discreto. Es decir, los electrones son expulsados del átomo con una gama de energías, en vez de las cantidades discretas de energía que se observa en rayos gamma y decaimiento alfa. Esto parecía indicar que laenergía no se conservaba en estos decaimiento. Posteriormente se descubrió que la energía sí se conserva, con el descubrimiento de los neutrinos.
En 1906 Ernest Rutherford publicó "El retraso de la partícula alfa del radio cuando atraviesa la materia", en Philosophical Magazine (12, p. 134-46). Hans Geiger amplió este trabajo en una comunicación a la Royal Society (Proc. Roy. Soc. 17 de julio de 1908) con experimentos y Rutherford se había hecho pasar aire a través de las partículas α, papel de aluminio y papel de aluminio dorado. Geiger y Marsden publicaron trabajos adicionales en 1909 (Proc. Roy. Soc. A82 p. 495-500) y ampliaron aún más el trabajo en la publicación de 1910 por Geiger (Proc. Roy. Soc. 1 de febrero de 1910). En 1911-2 Rutherford explicó ante la Royal Society los experimentos y propuso la nueva teoría del núcleo atómico. Por lo que se considera que Rutherford demostró en 1911 la existencia del núcleo atómico.1
Por esas mismas fechas (1909) Ernest Rutherford realizó un experimento en el que Hans Geiger y Ernest Marsden, bajo su supervisión dispararon partículas alfa (núcleos de helio) en una delgada lámina de oro. El modelo atómico de Thomson predecía que la de las partículas alfa debían salir de la lámina con pequeñas desviaciones de sus trayectorias. Sin embargo, descubrió que algunas partículas se dispersan a grandes ángulos, e incluso completamente hacia atrás en algunos casos. Este descubrimiento en1911, llevó al modelo atómico de Rutherford, en que el átomo está constituido por protones y electrones. Así, el átomo del nitrógeno-14 estaría constituido por 14 protones y 7 electrones.1
El modelo de Rutherford funcionó bastante bien durante muchos años. Se pensaba que la repulsión de las cargas positivas entre protones era solventada por los electrones -con carga negativa- interpuestos ordenadamente en medio, por lo que el electrón era considerado como un "cemento nuclear".1 Esto fue hasta que los estudios llevados a cabo por Franco Rasetti, en el Institute of Technology de California en 1929. En 1925 se sabía que los protones y electrones tiene un espín de 1 / 2, y en el modelo de Rutherford nitrógeno - 14 los 14 protones y seis de los electrones deberían cancelar sus contribuciones al espín total, estimándose un espín total de 1 / 2. Rasetti descubierto, sin embargo, que el nitrógeno - 14 tiene un espín total unidad.2
En 1930 Wolfgang Pauli no pudo asistir a una reunión en Tubinga, y en su lugar envió una carta famoso con la clásica introducción "Queridos Señoras y señores radiactivos ". En su carta Pauli sugirió que tal vez existía una tercera partícula en el núcleo, que la bautizó con el nombre de "neutrones". Sugirió que era más ligero que un electrón y sin carga eléctrica, y que no interactuaba fácilmente con la materia (y por eso todavía no se le había detectado). Esta hipótesis permitía resolver tanto el problema de la conservación de la energía en la desintegración beta y el espín de nitrógeno - 14, la primera porque los neutrones llevaban la energía no detectada y el segundo porque un electrón extra se acoplaba con el electrón sobrante en el núcleo de nitrógeno - 14 para proporcionar un espín de 1. Enrico Fermi redenominó en 1931 los neutrones de Pauli como neutrinos (en italiano pequeño neutral) y unos treinta años después se demostró finalmente que un neutrinos realmente se emiten en el decaimiento beta.
En 1932 James Chadwick se dio cuenta de que la radiación que de que había sido observado por Walther Bothe, Herbert L. Becker, Irène y Jean Frédéric Joliot-Curie era en realidad debido a una partícula que él llamó el neutrón. En el mismo año Dimitri Ivanenko sugirió que los neutrones eran, de hecho partículas de espín 1 / 2, que existían en el núcleo y que no existen electrones en el mismo, y Francis Perrin sugirió que los neutrinos son partículas nucleares, que se crean durante el decaimiento beta. Fermi publicó1934 una teoría de los neutrinos con una sólida base teórica. En el mismo año Hideki Yukawa propuso la primera teoría importante de la fuerza para explicar la forma en que el núcleo mantiene junto.
Luego del descubrimiento del neutrón, por James Chadwick, Werner Heisenberg (que enunció años antes el principio de incertidumbre), indicó que los neutrones pueden ser parte del núcleo, y no así los electrones. Con esta teoría se resolvía totalmente el problema del spin que no coincidía, además de explicar todos los aspectos del comportamiento nuclear.2
Sin embargo, la nueva teoría traía consigo otro severo problema: con el modelo anterior, que incluía electrones como "cemento nuclear", se explicaba que los protones, todos con la misma carga positiva, permanecieran totalmente juntos, sin que saliesen disparados por la repulsión de cargas iguales. Sin embargo, con el modelo que incluye el neutrón, no había explicación alguna respecto a la forma en que en núcleo se mantiene unido y no explota de inmediato (es decir, ningún elemento debería existir, con la única excepción del hidrógeno). Para ejemplificar, la fuerza con la que se repelen dos protones a la distancia que están (una diezbillonésima de centímetro), es de aproximadamente 240 newtons, fuerza suficiente para elevar en el aire un objeto de algo más de 24 kilogramos (nótese la enormidad inimaginable de esa fuerza dado que estamos hablando de dos protones, cuya masa es de algo más de 10-27 kilogramos)3
La enorme dificultad que sufría la teoría se fue resolviendo gradualmente. En 1927, Heisenberg propuso el principio de incertidumbre, que indica que mientras mayor sea la precisión con que conozcamos la velocidad de una partícula, con menor precisión podremos conocer su posición.4
En 1930 Einstein dedujo a partir de este principio, por medios matemáticos, que si el principio es correcto, también es correcto otro tipo de indeterminación sobre la medición de la energía existente en un sistema cerrado. Mientras menor sea el lapso de tiempo en el cual se quiere saber la cantidad de energía del sistema, con menor precisión se la podrá medir.3
Al momento de sugerir el modelo de núcleo protón-neutrón, en 1932, Heisenberg sugirió también la existencia de un campo de fuerza que unía los protones, por medio de la existencia efímera de una partícula. La existencia de esta partícula sería posible sólo por el principio de incertidumbre, en la versión enunciada por Einstein.5
El físico japonés, Hideki Yukawa, entonces se puso a analizar las propiedades de la partícula propuesta por Heisenberg, y en 1935 describió esas propiedades con precisión. La partícula sólo podría existir un instante de unos 5 × 10-24 segundos, tiempo suficiente para que pueda ir de un protón a otro, pero no más allá del núcleo del átomo. La energía necesaria para la existencia de esta partícula en ese breve periodo se ajusta al principio de incertidumbre en la versión de Einstein.5 Utilizando esas ecuaciones, la energía disponible en ese periodo sería de 20 pJ (pico julios, 2 × 10-11 J o 1,25 × 108 eV), lo que equivale a una partícula con una masa de 250 veces la del electrón.
Desde entonces hubo varios intentos de detectar esa partícula experimentalmente. Por supuesto que siendo una partícula que sólo existe un breve instante, y utilizando energía no disponible, sólo gracias al principio de incertidumbre, sería imposible de detectar, excepto si esa energía fuese proporcionada. Los rayos cósmicos -partículas que llegan del espacio a enormes velocidades- pueden proporcionar esa energía. En 1948, experimentando con rayos cósmicos en Bolivia, la partícula fue detectada por Cecil Frank Powell. La partícula fue llamada Pion.6
Descripción del núcleo[editar]
Forma y tamaño del núcleo[editar]
Los núcleos atómicos son mucho más pequeños que el tamaño típico de un átomo (entre 10 mil y 100 mil veces más pequeños). Además contienen más del 99% de la masa con lo cual la densidad másica del núcleo es muy elevada. Los núcleos atómicos tienen algún tipo de estructura interna, por ejemplo los neutrones y protones parecen estar orbitando unos alrededor de los otros, hecho que se manifiesta en la existencia del momento magnético nuclear. Sin embargo, los experimentos revelan que el núcleo se parece mucho a una esfera o elipsoide compacto de 10-15 m (= 1 fm), en el que la densidad parece prácticamente constante. Naturalmente el radio varía según el número de protones y neutrones, siendo los núcleos más pesados y con más partículas algo más grandes. La siguiente fórmula da el radio del núcleo en función del número de nucleones A:
Donde
La densidad de carga eléctrica del núcleo es aproximadamente constante hasta la distancia y luego decae rápidamente hasta prácticamente 0 en una distancia de acuerdo con la fórmula:
Donde r es la distancia radial al centro del núcleo atómico.
Las aproximaciones anteriores son mejores para núcleos esféricos, aunque la mayoría de núcleos no parecen ser esféricos como revela que posean momento cuadrupolar diferente de cero. Este momento cuadrupolar se manifiesta en la estructura hiperfina de los espectros atómicos y hace que el campo eléctrico del núcleo no sea un campo coulombiano con simetría esférica.
Estabilidad del núcleo[editar]
Los núcleos atómicos se comportan como partículas compuestas a energías suficientemente bajas. Además, la mayoría de núcleos atómicos por debajo de un cierto peso atómico y que además presentan un equilibrio entre el número de neutrones y el número de protones (número atómico) son estables. Sin embargo, sabemos que los neutrones aislados y los núcleos con demasiados neutrones (o demasiados protones) son inestables o radiactivos.
La explicación de esta estabilidad de los núcleos reside en la existencia de los piones. Aisladamente los neutrones pueden sufrir vía interacción débil la siguiente desintegración:
(1)
Sin embargo, dentro del núcleo atómico la cercanía entre neutrones y protones hace que sean mucho más rápidas, víainteracción fuerte las reacciones:
(2)
Esto hace que continuamente los neutrones del núcleo se transformen en protones, y algunos protones en neutrones, esto hace que la reacción () apenas tenga tiempo de acontecer, lo que explica que los neutrones de los núcleos atómicos sean mucho más estable que los neutrones aislados. Si el número de protones y neutrones se desequilibra, se abre la posibilidad de que en cada momento haya más neutrones y sea más fácil la ocurrencia de la reacción ().
Modelos de estructura del núcleo atómico[editar]
En 1808 el químico inglés John Dalton propone una nueva teoría sobre la constitución de la materia. Según Dalton toda la materia está formada por átomos indivisibles e invisibles, estos a su vez se unen para formar compuestos en proporciones enteras fijas y constantes. De hecho Dalton propuso la existencia de los átomos como una hipótesis para explicar porqué los átomos sólo se combinaban en ciertas combinaciones concretas. El estudio de esas combinaciones le llevó a poder calcular los pesos atómicos. Para Dalton la existencia del núcleo atómico era desconocida y se consideraba que no existían partes más pequeñas.
En 1897 Joseph John Thomson fue el primero en proponer un modelo estructural interno del átomo. Thomson fue el primero en identificar el electrón como partícula subatómica de carga negativa y concluyó que «si los átomos contienen partículas negativas y la materia se presenta con neutralidad de carga, entonces deben existir partículas positivas». Es así como Thomson postuló que el átomo debe ser una esfera compacta positiva en la cual se encontrarían incrustados los electrones en distintos lugares, de manera que la cantidad de carga negativa sea igual a la carga positiva.
Así ni el modelo atómico de Dalton ni el de Thomson incluían ninguna descripción del núcleo atómico. La noción de núcleo atómico surgió en 1911 cuando Ernest Rutherford y sus colaboradores Hans Geiger y Ernest Marsden, utilizando un haz de radiación alfa, bombardearon hojas laminadas metálicas muy delgadas, colocando una pantalla de sulfuro de zinc a su alrededor, sustancia que tenía la cualidad de producir destellos con el choque de las partículas alfa incidentes. La hoja metálica fue atravesada por la mayoría de las partículas alfa incidentes; algunas de ellas siguieron en línea recta, otras fueron desviadas de su camino, y lo más sorprendente, muy pocas rebotaron contra la lámina.
A la luz de la fórmula dispersión usada por Rutherford:
(1)
Donde:
- , siendo la constante dieléctrica del vacío y , es la carga eléctrica del centro dispersor.
- , es la energía cinética inicial de la partícula alfa incidente.
- es el parámetro de impacto.
Los resultados del experimento requerían parámetros de impacto muy pequeños, y por tanto que el núcleo estuviera concentrado en la parte central, el núcleo de carga positiva, donde estaría concentrada la masa del átomo. con ello explicaba la desviación de las partículas alfa (partículas de carga positiva). Los electrones se encontrarían en una estructura externa girando en órbitas circulares muy alejadas del núcleo, lo que explicaría el paso mayoritario de las partículas alfa a través de la lámina de oro.
En 1913 Niels Bohr postula que los electrones giran a grandes velocidades alrededor del núcleo atómico. Los electrones se disponen en diversas órbitas circulares, las cuales determinan diferentes niveles de energía. El electrón puede acceder a un nivel de energía superior, para lo cual necesita "absorber" energía. Para volver a su nivel de energía original es necesario que el electrón emita la energía absorbida (por ejemplo en forma de radiación).
Comúnmente existen dos modelos diferentes describir el núcleo atómico:
- El modelo de la gota de agua
- El modelo de capas
Aunque dichos modelos son mutuamente excluyentes en sus hipótesis básicas tal como fueron formulados originalmente, A. Bohr y Mottelson construyeron un modelo mixto que combinaba fenomenológicamente características de ambos modelos.
Este modelo no pretende describir la compleja estructura interna del núcleo sino sólo las energías de enlace entre neutrones y protones así como algunos aspectos de los estados excitados de un núcleo atómico que se reflejan en los espectros nucleares. Fue inicialmente propuesto por Bohr (1935) y el núcleo en analogía con una masa de fluido clásico compuesto por neutrones y protones y una fuerza central coulombiana repulsiva proporcional al número de protones Z y con origen en el centro de la gota.
Desde el punto de vista cuantitativo se observa que la masa de un núcleo atómico es inferior a la masa de los componentes indiviudales (protones y neutrones) que lo forman. Esta no conservación de la masa está conectada con la ecuación de Einstein, por la cual parte de la masa está en forma de energía de ligazón entre dichos componentes. Cuantiativamente se tiene la siguiente ecuación:7
Donde:
- son respectivamente la masa del núcleo, la masa de un protón y la masa de un neutrón.
- son respectivamente el número atómico (que coincide con el número de protones), el número másico (que coincide con el número de nucleones) y A-Z por tanto coincide con el número de neturones.
- es la energía de enlace entre todos los nucleones.
El modelo de la gota de agua pretende describir la energía de enlace B a partir de consideraciones geométricas e interpreta la energía de los estados excitados de los núcleos como rotaciones o vibraciones semiclásicas de la "gota de agua" que representa el núcleo. En concreto en este modelo la energía de enlace se representa como B:8
Donde:
- este término representa el efecto favorable del volumen.
- este término representa el efecto desfavorable de la superficie.
- representa el efecto de la repulsión coulombiana entre protones.
- representa el hecho de que los núcleos "equilibrados" con un número similar de protones y neutrones son más estables.
- representa el hecho de que los núcleos con un número par de protones y neutrones, son más estables que los que tienen un número impar de ambas especies. Matemáticamente el término viene dado por:
Modelo de capas[editar]
Este es un modelo que trata de capturar parte de la estructura interna reflejada tanto en el momento angular del núcleo, como en su momento angular. Además el modelo pretende explicar porqué los núcleos con un "número mágico" de nucleones (neutrones y protones) resultan más estables (los números mágicos son 2, 8, 20, 28, 50, 82 y 126).
La explicación del modelo es que los nucleones se agrupan en "capas". Cada capa está formada por un conjunto de estados cuánticos con energías similares, la diferencia de energía entre dos capa es grande comparada con las variaciones de energía dentro de cada capa. Así dado que los nucleones son fermiones un núcleo atómico tendrá las capas de menor energía llena por lo que los nucleones no pueden caer a capas inferiores ya llenas. Las capas aquí deben entenderse en un sentido abstracto y no como capas físicas como las capas de una cebolla, de hecho la forma geométrica del espacio ocupado por un nucleón en un determinado estado de una capa se interpenetra con el espacio ocupado por nucleones de otras capas, de manera análoga a como las capas electrónicas se interpenetran en un átomo.
radioactividad
La radiactividad (o radioactividad) puede considerarse un fenómeno físico natural por el cual algunos cuerpos o elementos químicos, llamados radiactivos, emiten radiaciones que tienen la propiedad de impresionar placas fotográficas, ionizar gases, producir fluorescencia, atravesar cuerpos opacos a la luz ordinaria, etc.
Debido a esa capacidad, se les suele denominar radiaciones ionizantes (en contraste con las no ionizantes).
Las radiaciones emitidas pueden ser electromagnéticas, en forma de rayos X o rayos gamma, o bien corpusculares, como pueden ser núcleos de helio, electrones o positrones, protones u otras. En resumen, es un fenómeno que ocurre en los núcleos de ciertos elementos, que son capaces de transformarse en núcleos de átomos de otros elementos.
Debido a esa capacidad, se les suele denominar radiaciones ionizantes (en contraste con las no ionizantes).
Las radiaciones emitidas pueden ser electromagnéticas, en forma de rayos X o rayos gamma, o bien corpusculares, como pueden ser núcleos de helio, electrones o positrones, protones u otras. En resumen, es un fenómeno que ocurre en los núcleos de ciertos elementos, que son capaces de transformarse en núcleos de átomos de otros elementos.
La radiactividad puede ser:
- Natural: manifestada por los isótopos que se encuentran en la naturaleza.
- Artificial o inducida: manifestada por los radioisótopos producidos en transformaciones artificiales.
Radiactividad natural
En 1896 Henri Becquerel descubrió que ciertas sales de uranio emiten radiaciones espontáneamente, al observar que velaban las placas fotográficas envueltas en papel negro. Hizo ensayos con el mineral en caliente, en frío, pulverizado, disuelto en ácidos y la intensidad de la misteriosa radiación era siempre la misma. Por tanto, esta nueva propiedad de la materia, que recibió el nombre de radiactividad, no dependía de la forma física o química en la que se encontraban los átomos del cuerpo radiactivo, sino que era una propiedad que radicaba en el interior mismo del átomo.
Radiactividad artificial
La radiactividad artificial, también llamada radiactividad inducida, se produce cuando se bombardean ciertos núcleos estables con partículas apropiadas. Si la energía de estas partículas tiene un valor adecuado, penetran el núcleo bombardeado y forman un nuevo núcleo que, en caso de ser inestable, se desintegra después radiactivamente. Fue descubierta por los esposos Jean Frédéric Joliot-Curie e Irène Joliot-Curie, bombardeando núcleos de boro y de aluminio conpartículas alfa. Observaron que las sustancias bombardeadas emitían radiaciones después de retirar el cuerpo radiactivo emisor de las partículas de bombardeo.
Rayos Alfa (a)
Estos rayos están formados por partículas materiales que presentan dos unidades de carga eléctrica positiva y cuatro unidades de masa. Son ligeramente desviados por la acción de fuerzas magnéticas intensas. Pueden ionizar los gases y penetrar en la materia. Son detenidos o absorbidos cuando se pone ante ellos una lámina metálica. Su velocidad inicial varía desde 109 cm. /s hasta 2 x 109 cm. /s.
Rayos Beta (b)
Las partículas que conforman a los Rayos Beta son de una masa menor a la de los rayos alfa y son de unidad de carga negativa. Se proyectan a grandes velocidades, aunque ésta depende de la fuente de procedencia y en ocasiones son emitidos a una velocidad próxima a la de la luz (3×1010 cm. /s).
Rayos Gamma (g)
Su naturaleza es diferente a los rayos alfa y beta, puesto que no experimentan desviación ante los campos eléctricos y/o magnéticos. A pesar de que tienen una menor longitud de onda que los rayos X, actúan como una radiación electromagnética de igual naturaleza. Pueden atravesar láminas de plomo y recorre grandes distancias en el aire. Su naturaleza es ondulatoria y no tiene carga eléctrica, ni masa. Su capacidad de ionización es más débil en comparación con los rayos alfa y beta.
Equipo 4:
Fisión:
Cuando la fisión tiene lugar en un átomo de Uranio 235se obserba su triple fenómeno;
- Aparace una cantidad de energía, elevada en 200MeV que traduce la perdida de masa.
- Los produntos de ruptura (300 o´400)son radiactivos. Su presencia expleca los efectos de explosión de un artefacto nuclear.
- Cada nucleo fisionado emite 2 ó 3 neutrones que provocan el fenómeno de reacción en cadena y explican la noción de la masa crítica.
Se observa el mismo fenómeno de fusión en el plotinio 239 (artificial) y en el Uranio 233 (artificial). Ambos se fabrican a partir del Torio. Los nucleos se denominan nucleos flexibles.
Para que se produzca la fisión hace falta que el neutrón incidente reuna unas condiciones determinadas. Para actuar sobre el Uranio 235 y 233 y el Plutonio 239, el neutron ha de ser un neutron termicocuya energía es de la orden 1/40 eV, lo cual responde a una velocidad de 2 Km/s. El Uranio 238es igualmente fisible pero con neitrones rápidos cuya energía es 1MeV.
Fusión nuclear
La fusión de determinados núcleos de elementos ligeros es uno de los dos orígenes de energía nuclear, siendo la otra, la antes citada.
En la fusión intervienen los isótopos de hidrógeno (deuterio, tritio). Cuando se fusionan los nucleos de dichos isótopos se observa la aparición de energía que procede de la perdida de de masa, de acuerdo con la relación de Einstein E=m.c2.
La fusión de los átomos ligeros presenta dificultades especiales tanto desde el punto de vista teórico como del tecnológico. Esto ocurre por estar los nucleos cargados positivamente.
Fisión nuclear
En física nuclear, la fisión es una reacción nuclear, lo que significa que tiene lugar en el núcleo atómico. La fisión ocurre cuando un núcleo pesado se divide en dos o más núcleos pequeños, además de algunos subproductos como neutrones libres, fotones(generalmente rayos gamma) y otros fragmentos del núcleo como partículas alfa (núcleos de helio) y beta (electrones y positronesde alta energía).
Índice
[ocultar]Mecanismo[editar]
La fisión de núcleos pesados es un proceso exotérmico, lo que supone que se liberan cantidades sustanciales de energía. El proceso genera mucha más energía que la liberada en las reacciones químicas convencionales, en las que están implicadas lascortezas electrónicas; la energía se emite, tanto en forma de radiación gamma como de energía cinética de los fragmentos de la fisión, que calentarán la materia que se encuentre alrededor del espacio donde se produzca la fisión.
La fisión se puede inducir por varios métodos, incluyendo el bombardeo del núcleo de un átomo fisionable con una partícula de la energía correcta; la partícula es generalmente un neutrón libre. Este neutrón libre es absorbido por el núcleo, haciéndolo inestable (a modo de ejemplo, se podría pensar en la inestabilidad de una pirámide de naranjas en el supermercado, al lanzarse una naranja contra ella a la velocidad correcta). El núcleo inestable entonces se partirá en dos o más pedazos: los productos de la fisión que incluyen dos núcleos más pequeños, hasta siete neutrones libres (con una media de dos y medio por reacción), y algunos fotones.
Los núcleos atómicos lanzados como productos de la fisión pueden ser varios elementos químicos. Los elementos que se producen son resultado del azar, pero estadísticamente el resultado más probable es encontrar núcleos con la mitad de protones y neutrones del átomo fisionado original.
Los productos de la fisión son generalmente altamente radiactivos, no son isótopos estables; estos isótopos entonces decaen, mediante cadenas de desintegración.
Fisión fría y rotura de pares de nucleones[editar]
La mayor parte de las investigaciones sobre fisión nuclear se basan en la distribución de masa y energía cinética de los fragmentos de fisión. Sin embargo, esta distribución es perturbada por la emisión de neutrones por parte de los fragmentos antes de llegar a los detectores.
Aunque con muy baja probabilidad, en los experimentos se han detectado eventos de fisión fría, es decir fragmentos con tan baja energía de excitación que no emiten neutrones. Sin embargo, aún en esos casos, se observa la rotura de pares de nucleones, la que se manifiesta como igual probabilidad de obtener fragmentos con número par o impar de nucleones. Los resultados de estos experimentos permiten comprender mejor la dinámica de la fisión nuclear hasta el punto de escisión, es decir, antes de que se desvanezca la fuerza nuclear entre los fragmentos.
Inducción de la fisión[editar]
La fisión nuclear de los átomos fue descubierta en 1938 por los investigadores Otto Hahn y Fritz Strassmann a partir del trabajo desarrollado por el propio Hahn junto a Lise Meitner durante años anteriores. Por este descubrimiento recibió en 1944 el Premio Nobel de química. El estudio de la fisión nuclear se considera parte de los campos de la química nuclear y la física.
- Aunque la fisión es prácticamente la desintegración de materia radiactiva, comenzada a menudo de la manera más fácil posible (inducido), que es la absorción de un neutrón libre, puede también ser inducida lanzando otras cosas en un núcleo fisionable. Estas otras cosas pueden incluir protones, otros núcleos, o aún los fotones de gran energía en cantidades muy altas (porciones de rayos gamma).
- Muy rara vez, un núcleo fisionable experimentará la fisión nuclear espontánea sin un neutrón entrante.
- Cuanto más pesado es un elemento más fácil es inducir su fisión. La fisión en cualquier elemento más pesado que el hierro produce energía, y la fisión en cualquier elemento más liviano que el hierro requiere energía. Lo contrario también es verdad en las reacciones de fusión nuclear (la fusión de los elementos más livianos que el hierro produce energía y la fusión de los elementos más pesados que el hierro requiere energía).
- Los elementos más frecuentemente usados para producir la fisión nuclear son el uranio y el plutonio. El uranio es el elemento natural más pesado; el plutonio experimenta desintegraciones espontáneas y tiene un período de vida limitado. Así pues, aunque otros elementos pueden ser utilizados, estos tienen la mejor combinación de abundancia y facilidad de fisión.
Reacción en cadena[editar]
Una reacción en cadena ocurre como sigue: un acontecimiento de fisión empieza lanzando 2 ó 3 neutrones en promedio como subproductos. Estos neutrones se escapan en direcciones al azar y golpean otros núcleos, incitando a estos núcleos a experimentar fisión. Puesto que cada acontecimiento de fisión lanza 2 o más neutrones, y estos neutrones inducen otras fisiones, el proceso se acelera rápidamente y causa la reacción en cadena. El número de neutrones que escapan de una cantidad de uranio depende de su área superficial. Solamente los materiales fisibles son capaces de sostener una reacción en cadena sin una fuente de neutrones externa. Para que la reacción en cadena de fisión se lleve a cabo es necesario adecuar la velocidad de los neutrones libres, ya que si impactan con gran velocidad sobre el núcleo del elemento fisible, puede que simplemente lo atraviese o lo impacte, y que este no lo absorba.
Masa crítica[editar]
La masa crítica es la mínima cantidad de material requerida para que el material experimente una reacción nuclear en cadena. La masa crítica de un elemento fisionable depende de su densidad y de su forma física (barra larga, cubo, esfera, etc.). Puesto que los neutrones de la fisión se emiten en direcciones al azar, para maximizar las ocasiones de una reacción en cadena, los neutrones deberán viajar tan lejos como sea posible y de esa forma maximizar las posibilidades de que cada neutrón choque con otro núcleo. Así, una esfera es la mejor forma y la peor es probablemente una hoja aplanada, puesto que la mayoría de los neutrones volarían de la superficie de la hoja y no chocarían con otros núcleos.
También es importante la densidad del material. Si el material es gaseoso, es poco probable que los neutrones choquen con otro núcleo porque hay demasiado espacio vacío entre los átomos y un neutrón volaría probablemente entre ellos sin golpear nada. Si el material se pone bajo alta presión, los átomos estarán mucho más cercanos y la probabilidad de una reacción en cadena es mucho más alta. La alta compresión puede ser alcanzada poniendo el material en el centro de una implosión, o lanzando un pedazo de ella contra otro pedazo de ella muy fuertemente (con una carga explosiva, por ejemplo). Una masa crítica del material que ha comenzado una reacción en cadena se dice que se convierte en supercrítica.
Moderadores[editar]
Únicamente con juntar mucho uranio en un solo lugar no es suficiente como para comenzar una reacción en cadena. Los neutrones son emitidos por un núcleo en fisión a una velocidad muy elevada. Esto significa que los neutrones escaparán del núcleo antes de que tengan oportunidad de golpear cualquier otro núcleo (debido a un efecto relativista).
Un neutrón de movimiento lento se llama neutrón térmico y solamente esta velocidad del neutrón puede inducir una reacción de fisión. Así pues, tenemos cuatro velocidades de neutrones:
- Un neutrón (no-térmico) rápidamente se escapará del material sin interacción;
- Un neutrón de velocidad mediana será capturado por el núcleo y transformará el material en un isótopo (pero no induciría la fisión).
- Un neutrón de movimiento lento (térmico) inducirá a un núcleo a que experimente la fisión.
- Un neutrón móvil realmente lento será capturado o escapará, pero no causará fisión.
Algunos años antes del descubrimiento de la fisión, la manera acostumbrada de retrasar los neutrones era hacerlos pasar a través de un material de peso atómico bajo, tal como un material hidrogenoso. El proceso de retraso o de moderación es simplemente una secuencia de colisiones elásticas entre las partículas de alta velocidad y las partículas prácticamente en reposo. Cuanto más parecidas sean las masas del neutrón y de la partícula golpeada, mayor es la pérdida de energía cinética por el neutrón. Por lo tanto los elementos ligeros son los más eficaces como moderadores de neutrones.
A unos cuantos físicos en los años 30 se les ocurrió la posibilidad de mezclar el uranio con un moderador: si fuesen mezclados correctamente, los neutrones de alta velocidad de la fisión podrían ser retrasados al rebotar en un moderador, con la velocidad correcta, para inducir la fisión en otros átomos de uranio. Las características de un buen moderador son: peso atómico bajo y baja o nula tendencia a absorber los neutrones. Los moderadores posibles son entonces el hidrógeno, helio, litio, berilio, boro y carbono. El litio y el boro absorben los neutrones fácilmente, así que se excluyen. El helio es difícil de utilizar porque es un gas y no forma ningún compuesto. La opción de moderadores estaría entonces entre el hidrógeno, deuterio, el berilio y el carbono. Fueron Enrico Fermi y Leó Szilárd quienes propusieron primero el uso de grafito (una forma de carbono) como moderador para una reacción en cadena. El deuterio es el mejor tecnológicamente (introducido en el agua pesada), sin embargo el grafito es mucho más económico.
Efectos de los isótopos[editar]
El uranio natural se compone de tres isótopos: 234U (0,006%), 235U (0,7%), y 238U (99,3%). La velocidad requerida para que se produzca un acontecimiento de fisión y no un acontecimiento de captura es diferente para cada isótopo.
El uranio-238 tiende a capturar neutrones de velocidad intermedia, creando 239U, que decae sin fisión a plutonio-239, que sí es fisible. Debido a su capacidad de producir material fisible, a este tipo de materiales se les suele llamar fértiles.
Los neutrones de alta velocidad (52.000 km/s), como los producidos en una reacción de fusión tritio-deuterio, pueden fisionar el uranio-238. Sin embargo los producidos por la fisión del uranio-235, de hasta 28.000 km/s, tienden a rebotar inelásticamente con él, lo cual los desacelera. En un reactor nuclear, el 238U tiende, pues, tanto a desacelerar los neutrones de alta velocidad provenientes de la fisión del uranio-235 como a capturarlos (con la consiguiente transmutación a plutonio-239) cuando su velocidad se modera.
El uranio-235 fisiona con una gama mucho más amplia de velocidades de neutrones que el 238U. Puesto que el uranio-238 afecta a muchos neutrones sin inducir la fisión, tenerlo en la mezcla es contraproducente para promover la fisión. De hecho, la probabilidad de la fisión del 235U con neutrones de velocidad alta puede ser lo suficientemente elevada como para hacer que el uso de un moderador sea innecesario una vez que se haya suprimido el 238U.
Sin embargo, el 235U está presente en el uranio natural en cantidades muy reducidas (una parte por cada 140). La diferencia relativamente pequeña en masa entre los dos isótopos hace, además, que su separación sea difícil. La posibilidad de separar 235U fue descubierta con bastante rapidez en el proyecto Manhattan, lo que tuvo gran importancia para su éxito.
Fusión nuclear
En física nuclear, fusión nuclear es el proceso por el cual varios núcleos atómicos de carga similar se unen y forman un núcleo más pesado.1 Simultáneamente se libera o absorbe una cantidad enorme de energía, que permite a la materia entrar en un estadoplasmático.
La fusión de dos núcleos de menor masa que el hierro (en este elemento y en el níquel ocurre la mayor energía de enlace nuclear por nucleón) libera energía en general. Por el contrario, la fusión de núcleos más pesados que el hierro absorbe energía. En el proceso inverso, la fisión nuclear, estos fenómenos suceden en sentidos opuestos.
En el caso más simple de fusión, en el hidrógeno, dos protones deben acercarse lo suficiente para que la interacción nuclear fuertepueda superar su repulsión eléctrica mutua y obtener la posterior liberación de energía.
En la naturaleza ocurre fusión nuclear en las estrellas, incluido el Sol. En su interior las temperaturas son cercanas a 15 millones de grados Celsius.2 Por ello a las reacciones de fusión se les denomina termonucleares. En varias empresas se ha logrado también la fusión (artificial), aunque todavía no ha sido totalmente controlada.
Sobre la base de los experimentos de transmutación nuclear de Ernest Rutherford, conducidos pocos años antes, Mark Oliphant, en 1932, observó por primera vez la fusión de núcleos ligeros (isótopos de hidrógeno).
Posteriormente, durante el resto de ese decenio, Hans Bethe estudió las etapas del ciclo principal de la fusión nuclear en las estrellas.
La investigación acerca de la fusión para fines militares se inició en la década de 1940 como parte del Proyecto Manhattan, pero no tuvo éxito hasta 1952. La indagación relativa a fusión controlada con fines civiles se inició en la década de 1950, y continúa hasta el presente.
Índice
[ocultar]Requisitos[editar]
Para que pueda ocurrir la fusión debe superarse una importante barrera de energía producida por la fuerza electrostática. A grandes distancias, dos núcleos se repelen debido a la fuerza de repulsión electrostática entre sus protones, cargados positivamente. Sin embargo, si se pueden acercar dos núcleos lo suficiente, debido a la interacción nuclear fuerte, que en distancias cortas es mayor, se puede superar la repulsión electrostática.
Cuando un nucleón (protón o neutrón) se añade a un núcleo, la fuerza nuclear atrae a otros nucleones, pero –debido al corto alcance de esta fuerza– principalmente a sus vecinos inmediatos. Los nucleones del interior de un núcleo tienen más vecinos nucleones que los existentes en la superficie. Ya que la relación entre área de superficie y volumen de los núcleos menores es mayor, por lo general la energía de enlace por nucleón debido a la fuerza nuclear aumenta según el tamaño del núcleo, pero se aproxima a un valor límite correspondiente al de un núcleo cuyo diámetro equivalga al de casi cuatro nucleones. Por otra parte, la fuerza electrostática es inversa al cuadrado de la distancia. Así, a un protón añadido a un núcleo le afectará una repulsión electrostática de todos los otros protones. Por tanto, debido a la fuerza electrostática, cuando los núcleos se hacen más grandes, la energía electrostática por nucleón aumenta sin límite.
El resultado neto de estas fuerzas opuestas es que generalmente la energía de enlace por nucleón aumenta según el tamaño del núcleo, hasta llegar a los elementos hierro y níquel, y un posterior descenso en los núcleos más pesados. Finalmente la energía de enlace nuclear se convierte en negativa, y los núcleos más pesados (con más de 208 nucleones, correspondientes a un diámetro de alrededor de seis nucleones) no son estables. Cuatro núcleos muy estrechamente unidos, en orden decreciente de energía de enlace nuclear, son 62Ni, 58Fe, 56Fe, y 60Ni.3 A pesar de que el isótopo de níquel 62Ni es más estable, el isótopo de hierro 56Fe es una orden de magnitud más común. Esto se debe a mayor tasa de desintegración de 62Ni en el interior de las estrellas, impulsada por absorción defotones.
Una notable excepción a esta tendencia general es el núcleo helio 4He, cuya energía de enlace es mayor que la dellitio, el siguiente elemento por incremento de peso. En el principio de exclusión de Pauli se proporciona una explicación a esta excepción: debido a que los protones y los neutrones son fermiones, no pueden existir en el mismo estado. A causa de que el núcleo del 4He está integrado por dos protones y dos neutrones, de modo que sus cuatro nucleones pueden estar en el estado fundamental, su energía de enlace es anormalmente grande. Cualquier nucleón adicional tendría que ubicarse en estados de energía superiores.
Tres ventajas de la fusión nuclear son:
a) en gran parte sus desechos no revisten la problemática de los provenientes de fisión;
b) abundancia –y buen precio–[cita requerida] de materias primas, principalmente del isótopo de hidrógeno deuterio (D);
c) si una instalación dejara de funcionar se apagaría inmediatamente, sin peligro de fusión no nuclear.
a) en gran parte sus desechos no revisten la problemática de los provenientes de fisión;
b) abundancia –y buen precio–[cita requerida] de materias primas, principalmente del isótopo de hidrógeno deuterio (D);
c) si una instalación dejara de funcionar se apagaría inmediatamente, sin peligro de fusión no nuclear.
En un diseño prometedor, para iniciar la reacción, varios rayos láser de alta potencia transfieren energía a una pastilla de combustible pequeña, que se calienta y se genera unaimplosión: desde todos los puntos se colapsa y se comprime hasta un volumen mínimo, lo cual provoca la fusión nuclear.4