Estado de agregación

En física y química se observa que, para cualquier sustancia o mezcla, modificando sus condiciones detemperatura o presión, pueden obtenerse distintos estados o fases, denominados estados de agregación de la materia, en relación con lasfuerzas de unión de las partículas (moléculas, átomos o iones) que la constituyen.
Todos los estados de agregación poseen propiedades y características diferentes; los más conocidos y observables cotidianamente son cuatro, llamados fases sólida, líquida, gaseosay plasmática. También son posibles otros estados que no se producen de forma natural en nuestro entorno, por ejemplo: condensado de Bose-Einstein,condensado fermiónico y estrellas de neutrones. Se cree que también son posibles otros, como el plasma de quark-gluón.[1]
Estado sólido
Los objetos en estado sólido se presentan como cuerpos de forma definida; sus átomos a menudo se entrelazan formando estructuras estrechas definidas, lo que les confiere la capacidad de soportar fuerzas sin deformación aparente. Son calificados generalmente como duros y resistentes, y en ellos las fuerzas de atracción son mayores que las de repulsión. En lossólidos cristalinos, la presencia de espacios intermoleculares pequeños da paso a la intervención de las fuerzas deenlace, que ubican a las celdillas en formas geométricas. En los amorfos o vítreos, por el contrario, las partículas que los constituyen carecen de una estructura ordenada.
Las sustancias en estado sólido suelen presentar algunas de las siguientes características:
- Cohesión elevada;
- Tienen una forma definida y memoria de forma, presentando fuerzas elásticas restitutivas si se deforman fuera de su configuración original;
- A efectos prácticos sonincompresibles,
- Resistencia a la fragmentación;
- Fluidez muy baja o nula;
- Algunos de ellos se subliman.
Estado líquido
Si se incrementa la temperatura de un sólido, este va perdiendo forma hasta desaparecer la estructura cristalina, alcanzando el estado líquido. Característica principal: la capacidad de fluir y adaptarse a la forma del recipiente que lo contiene. En este caso, aún existe cierta unión entre los átomos del cuerpo, aunque mucho menos intensa que en los sólidos. El estado líquido presenta las siguientes características:
- Cohesión menor.
- Movimiento energía cinética.
- Son fluidos, no poseen forma definida, ni memoria de forma por lo que toman la forma de la superficie o el recipiente que lo contiene.
- En el frío se contrae (exceptuando el agua).
- Posee fluidez a través de pequeños orificios.
- Puede presentar difusión.
- Son poco compresibles.
Estado gaseoso
Se denomina gas al estado de agregación de la materia que no tiene forma ni volumen definido. Su principal composición son moléculas no unidas, expandidas y con poca fuerza de atracción, haciendo que no tengan volumen y forma definida, provocando que este se expanda para ocupar todo el volumen del recipiente que la contiene, con respecto a los gases las fuerzas gravitatorias y de atracción entre partículas resultan insignificantes. Es considerado en algunos diccionarios como sinónimo de vapor, aunque no hay que confundir sus conceptos, ya que el término de vapor se refiere estrictamente para aquel gas que se puede condensar por presurización a temperatura constante. Los gases se expanden libremente hasta llenar el recipiente que los contiene, y su densidad es mucho menor que la de los líquidos y sólidos.
Dependiendo de sus contenidos de energía o de las fuerzas que actúan, la materia puede estar en un estado o en otro diferente: se ha hablado durante la historia, de un gas ideal o de un sólido cristalino perfecto, pero ambos son modelos límites ideales y, por tanto, no tienen existencia real.
En los gases reales no existe un desorden total y absoluto, aunque sí un desorden más o menos grande.
En un gas, las moléculas están en estado de caos y muestran poca respuesta a la gravedad. Se mueven tan rápidamente que se liberan unas de otras. Ocupan entonces un volumen mucho mayor que en los otros estados porque dejan espacios libres intermedios y están enormemente separadas unas de otras. Por eso es tan fácil comprimir un gas, lo que significa, en este caso, disminuir la distancia entre moléculas. El gas carece de forma y de volumen, porque se comprende que donde tenga espacio libre allí irán sus moléculas errantes y el gas se expandirá hasta llenar por completo cualquier recipiente.
El estado gaseoso presenta las siguientes características:
- Cohesión casi nula.
- No tienen forma definida.
- Su volumen es variable.
Estado plasmático
El plasma es un gas ionizado, es decir que los átomos que lo componen se han separado de algunos de sus electrones. De esta forma el plasma es un estado parecido al gas pero compuesto por aniones y cationes(iones con carga negativa y positiva, respectivamente), separados entre sí y libres, por eso es un excelente conductor. Un ejemplo muy claro es elSol.
En la baja Atmósfera terrestre, cualquier átomo que pierde un electrón (cuando es alcanzado por una partícula cósmica rápida) se dice que está ionizado. Pero a altas temperaturas es muy diferente. Cuanto más caliente está el gas, más rápido se mueven sus moléculas yátomos, (ley de los gases ideales) y a muy altas temperaturas las colisiones entre estos átomos, moviéndose muy rápido, son suficientemente violentas para liberar los electrones. En la atmósfera solar, una gran parte de los átomos están permanentemente «ionizados» por estas colisiones y el gas se comporta como un plasma.
A diferencia de los gases fríos (por ejemplo, el aire a temperatura ambiente), los plasmas conducen laelectricidad y son fuertemente influidos por los campos magnéticos. La lámpara fluorescente, contiene plasma (su componente principal es vapor de mercurio) que calienta y agita la electricidad, mediante la línea de fuerza a la que está conectada la lámpara. La línea, positivo eléctricamente un extremo y negativo, causa que los iones positivos se aceleren hacia el extremo negativo, y que los electrones negativos vayan hacia el extremo positivo. Las partículas aceleradas ganan energía, colisionan con los átomos, expulsan electrones adicionales y mantienen el plasma, aunque se recombinen partículas. Las colisiones también hacen que los átomos emitan luz y esta forma de luz es más eficiente que las lámparas tradicionales. Los letreros de neón y las luces urbanas funcionan por un principio similar y también se usaron en electrónicas.
Perfil de la ionosfera
La parte superior de la ionosfera se extiende en el espacio algunos cientos de kilómetros y se combina con lamagnetosfera, cuyo plasma está generalmente más rarificado y también más caliente. Los iones y los electronesdel plasma de la magnetosfera provienen de la ionosfera que está por debajo y del viento solar y muchos de los pormenores de su entrada y calentamiento no están claros aún.
Existe el plasma interplanetario, el viento solar. La capa más externa delSol, la corona, está tan caliente que no sólo están ionizados todos sus átomos, sino que aquellos que comenzaron con muchos electrones, tienen arrancados la mayoría (a veces todos), incluidos los electrones de las capas más profundas que están más fuertemente unidos. En la corona del Sol se ha detectado laradiación electromagnéticacaracterística del hierro que ha perdido 13 electrones.
Esta temperatura extrema evita que el plasma de la corona permanezca cautivo por la gravedad solar y, así, fluye en todas direcciones, llenando elSistema Solar más allá de los planetas más distantes.
- Propiedades del plasma
- Hay que decir que hay 2 tipos de plasma, fríos y calientes:
- En los plasmas fríos, los átomos se encuentran a temperatura ambiente y son los electrones los que se aceleran hasta alcanzar una temperatura de 5000 °C. Pero como los iones, que son muchísimo más masivos, están a temperatura ambiente, no queman al tocarlos.
- En los plasmas calientes, la ionización se produce por los choques de los átomos entre sí. Lo que hace es calentar un gas mucho y por los propios choques de los átomos entre sí se ionizan. Estos mismos átomos ionizados también capturan electrones y en ese proceso se genera luz (por eso el Sol brilla, y brilla el fuego, y brillan los plasmas de los laboratorios).
La elasticidad es la propiedad de un objeto o material que causa que sea restaurado a su forma original, después de la distorsión. Se dice que es más elástica, si se restablece por sí mismo a su configuración original, de forma más precisa. Una tira de goma es fácil de estirar, y se ajusta de nuevo hasta cerca de su longitud original cuando se libera, pero no es tan elástica como un trozo de cuerda de piano. La cuerda de piano es más difícil de estirar, pero se dice que es más elástica que la tira de goma, porque retorna a su longitud original de manera mas precisa. Una cuerda de piano real puede ser golpeada cientos de veces, sin que se estire suficientemente para llevarla fuera de tono de forma notable. Un muelle es un ejemplo de objeto elástico -cuando se estiran, ejerce una fuerza de restauración que tiende a traerlo de vuelta a su longitud original-. En general, esta fuerza restauradora es proporcional a la cantidad de estiramiento, como se describe por medio de la Ley de Hooke. Para cables o volúmenes, la elasticidad se describe generalmente, en términos de cantidad de deformación (tensión) resultante de un estiramiento determinado (módulo de Young). Las propiedades elásticas de los volúmenes de materiales describe la respuesta de los materiales a los cambios de presión.
Hidrostática
La hidrostática es la rama de la mecánica de fluidos o de la hidráulica que estudia los fluidos incompresibles en estado de equilibrio; es decir, sin que existan fuerzas que alteren su movimiento o posición, en contraposición a la dinámica de fluidos.
Características de los fluidos
Se denomina fluido a aquél medio continuo formado por alguna sustancia entre cuyas moléculas sólo hay una fuerza de atracción débil. La propiedad definitoria es que los fluidos pueden cambiar de forma sin que aparezcan en su seno fuerzas restitutivas tendentes a recuperar la forma "original" (lo cual constituye la principal diferencia con un sólido deformable, donde sí hay fuerzas restitutivas).
Los estados de la materia líquido,gaseoso y plasma son fluidos, además de algunos sólidos que presentan características propias de éstos, un fenómeno conocido como solifluxión y que lo presentan, entre otros, los glaciares y el magma.
Las caracteristicas principales que presenta todo fluido son:
- Cohesión. Fuerza que mantiene unidas a las moléculas de una misma sustancia.
- Tensión superficial. Fenómeno que se presenta debido a la atracción entre las moléculas de la superfíciede un líquido.
- Adherencia. Fuerza de atracción que se manifiesta entre las moléculas de dos sustancias diferentes en contacto.
- Capilaridad. Se presenta cuando existe contacto entre un líquido y una pared sólida, debido al fenómeno de adherencia. En caso de ser la pared un recipiente o tubo muy delgado (denominados "capilares") este fenómeno se puede apreciar con mucha claridad.
Presión
La presión se define como fuerza por unidad de área. Para describir la influencia sobre el comportamiento de un fluido, usualmente es mas conveniente usar la presión que la fuerza. La unidad estándar de presión es el Pascal, el cual es un Newton por metro cuadrado.
Para un objeto descansando sobre una superficie, la fuerza que presiona sobre la superficie es el peso del objeto, pero en distintas orientaciones, podría tener un área de contacto con la superficie diferente y de esta forma ejercer diferente presión.
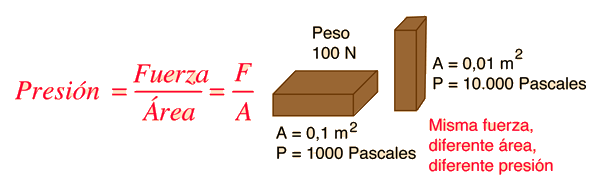
Cálculo de la Presión
Hay muchas situaciones físicas donde la presión es la variable más importante. Si usted está pelando una manzana, entonces la presión es la variable clave: si el cuchillo está afilado, entonces el área de contacto es pequeño y se puede pelar ejerciendo menos fuerza sobre el cuchillo. Si usted tiene que recibir una inyección, entonces la presión es la variable más importante para conseguir que la aguja penetre a través de la piel: es mejor tener una aguja afilada que una roma, ya que el área más pequeña de contacto, implica que se requiere menos fuerza para empujar la aguja través de la piel
Al estudiar la presión de un líquido en reposo el medio es tratado como una distribución continua de la materia. Pero si tratamos con la presión de gas, debe entenderse como una presión media de las colisiones moleculares contra las paredes del recipiente.
La presión en un fluido se puede ver como una medida de la energía por unidad de volumenpor medio de la definición de trabajo. Esta energía se relaciona con las otras formas de energía del fluido por medio de la ecuación de Bernoulli.
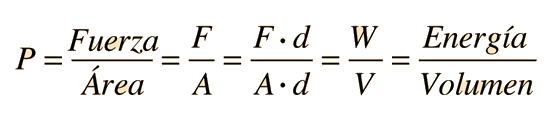
Se describe como presión al acto y resultado de comprimir, estrujar o apretar; a la coacción que se puede ejercer sobre un sujeto o conjunto; o la magnitud física que permite expresar el poder o fuerza que se ejerce sobre un elemento o cuerpo en una cierta unidad de superficie.
La hidrostática, por su parte, es la rama de la mecánica que se especializa en el equilibrio de los fluidos. El término también se utiliza como adjetivo para referirse a lo que pertenece o está vinculado a dicha área de la mecánica.
La presión hidrostática, por lo tanto, da cuenta de la presión o fuerza que el peso de un fluido en reposo puede llegar a provocar. Se trata de la presión que experimenta un elemento por el sólo hecho de estar sumergido en un líquido.
El fluido genera presión sobre el fondo, los laterales del recipiente y sobre la superficie del objeto introducido en él. Dicha presión hidrostática, con el fluido en estado de reposo, provoca una fuerza perpendicular a las paredes del envase o a la superficie del objeto.
El peso ejercido por el líquido sube a medida que se incrementa la profundidad. La presión hidrostática es directamente proporcional al valor de la gravedad, la densidad del líquido y la profundidad a la que se encuentra.
La presión hidrostática (p) puede ser calculada a partir de la multiplicación de la gravedad (g), la densidad (d) del líquido y la profundidad (h). En ecuación: p = d x g x h.
Este tipo de presión es muy estudiada en los distintos centros educativos para que los jóvenes puedan entenderla bien y ver cómo la misma se encuentra en su día a día. Así, por ejemplo, uno de los experimentos más utilizados por los profesores de Ciencias para explicar aquella es la que se realiza mezclando diversos fluidos.
En este caso concreto, es habitual que apuesten por introducir en un vaso o cubeta agua, aceite y alcohol. Así, en base a las densidades de cada uno de estos líquidos se consigue que el agua quede abajo del todo, el aceite sobre ella y finalmente sobre ambos se situará el alcohol. Y es que este cuenta con una mayor densidad.
Si el fluido se encuentra en movimiento, ya no ejercerá presión hidrostática, sino que pasará a hablarse de presión hidrodinámica. En este caso, estamos ante una presión termodinámica que depende de la dirección tomada a partir de un punto.
En el ámbito sanitario se habla también de lo que se conoce como presión hidrostática capilar para definir a aquella que se sustenta en el bombeo del corazón y que lo que hace es empujar la sangre a través de los vasos. Frente a ella está también la presión hidrostática intersticial que, por su parte, es la que lleva a cabo el líquido intersticial, que es aquel que se encuentra alojado en el espacio que hay entre las células.
Asimismo en este campo, también está la llamada presión osmótica capilar que es la que desarrollan las proteínas plasmáticas, empujan el agua hacia el interior del vaso en cuestión. Y finalmente nos encontramos con la presión osmótica intersticial, que también realizan aquellas proteínas pero que se define por una concentración más baja que la anterior.
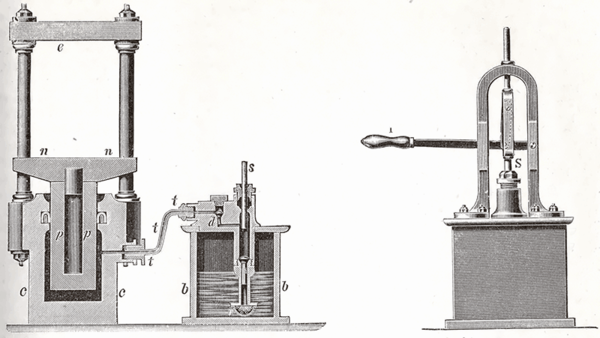
Prensa hidráulica
La prensa hidráulica es un mecanismo conformado porvasos comunicantes impulsados porpistones de diferentes áreas que, mediante una pequeña fuerza sobre el pistón de menor área, permite obtener una fuerza mayor en el pistón de mayor área. Los pistones son llamados pistones de agua, ya que son hidráulicos. Estos hacen funcionar conjuntamente a las prensas hidráulicas por medio de motores.
En el siglo XVII, en Francia, el matemático y filósofo Blaise Pascalcomenzó una investigación referente al principio mediante el cual la presiónaplicada a un líquido contenido en un recipiente se transmite con la misma intensidad en todas direcciones.[1]Gracias a este principio se pueden obtener fuerzas muy grandes utilizando otras relativamente pequeñas. Uno de los aparatos más comunes para alcanzar lo anteriormente mencionado es la prensa hidráulica, la cual está basada en el principio de Pascal.
El rendimiento de la prensa hidráulica guarda similitudes con el de la palanca, pues se obtienen fuerzas mayores que las ejercidas pero se aminora la velocidad y la longitud de desplazamiento, en similar proporción.[2]
Cálculo de la relación de fuerzas
Cuando se aplica una fuerza  sobre el émbolo de menor área
sobre el émbolo de menor área 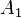 se genera una presión
se genera una presión  :
:
Del mismo modo en el segundo émbolo:
Se observa que el líquido está comunicado, luego por el principio de Pascal, la presión en los dos pistones es la misma. Por tanto se cumple que:
Esto es:
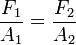 y la relación de fuerzas:
y la relación de fuerzas: 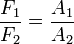
Luego, la fuerza resultante de la prensa hidráulica es:
Donde:
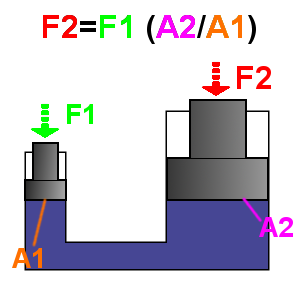
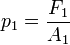
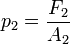


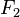 = fuerza del émbolo mayor en N.
= fuerza del émbolo mayor en N.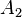 = área del émbolo mayor en m².
= área del émbolo mayor en m².